利用下图进行浓硫酸与铜反应,并验证二氧化硫的性质。
实验操作如下:连接仪器和安放药品,用酒精灯加热1分钟后撤去酒精灯,将铜丝伸入液面以下,一段时间后拉起铜丝。
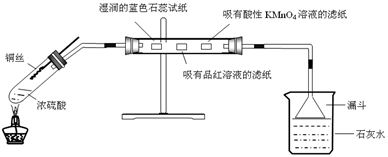
请回答下列问题:
(1)将反应后的试管充分静置,观察到试管底部有白色固体出现,中间层是浅黄色液体(浓硫酸),上层是蓝色溶液。白色固体的化学式为 ,上述现象中体现了浓硫酸的性质有 (填序号)
①酸性 ②强氧化性 ③吸水性 ④脱水性
(2)直玻璃管中依次观察到的现象是: ;
; 。
(3)某次实验中小烧杯中澄清石灰水始终未观察到浑浊,你猜想可能的原因是 ,请设计实验证明它 。
(4)某学生发现,常温下将铜片长时间放入浓硫酸的试管中并密封,最终生成黑色物质(Cu2S)和蓝色溶液,无气体生成,写出此条件下铜片与浓硫酸反应的化学方程式: 。
(1)CuSO4(2分),①②③(2分)
(2)蓝色石蕊试纸变为红色(2分);红色滤纸变为白色(2分);
紫红色滤纸变为白色(2分)
(3)SO2易溶于水,大量SO2与Ca(OH)2生成易溶于水的Ca(HSO3)2而不产生CaSO3浑浊(2分);取小烧杯中溶液少许于另一支试管中,加入足量NaOH溶液,若有白色沉淀生成,则证明猜想合理(3分)。
(4)5Cu+4H2SO4(浓)=Cu2S+3CuSO4+4H2O(3分)
考查SO2的制取及性质:铜与浓硫酸的反应为:Cu+2H2SO4(浓)=CuSO4+SO2↑+2H2O
(1)在上述反应中,浓硫酸部分被还原为SO2,呈现氧化性,部分体现酸性,生成CuSO4,试管低部的白色固体为硫酸铜固体,说明浓硫酸可将CuSO4·5H2O的水可吸收掉,体现了浓硫酸的吸水性
(2)SO2为酸性氧化物,遇水生成中强酸:SO2+H2O=H2SO3,可使蓝色石蕊试纸变为红色;SO2具有漂白性,可漂白品红试纸;SO2具有还原性,可将KMnO4紫色溶液还原为无色
(3)当碱过量时,生成白色浑浊:SO2+Ca(OH)2=CaSO3↓=H2O,但当有大量SO2与石灰水反应时,Ca(OH)2+2SO2=Ca(HSO3)2,Ca(HSO3)2易溶于水,并无浑浊出现
酸式盐Ca(HSO3)2可与碱反应生成不溶于水的CaSO3:故可取小烧杯中溶液少许于另一支试管中,加入足量NaOH溶液,若有白色沉淀生成,则证明猜想合理
(4)根据化合价的升降守恒,可配平此反应:5Cu+4H2SO4(浓)=Cu2S+3CuSO4+4H2O
