已知FeSO4·7H2O晶体在加热条件下发生如下反应:
2FeSO4·7H2O Fe2O3+SO2↑+SO3↑+14H2O↑;下图的装置可用来检验上述反应中所有的气体产物,请回答下列问题:
Fe2O3+SO2↑+SO3↑+14H2O↑;下图的装置可用来检验上述反应中所有的气体产物,请回答下列问题:
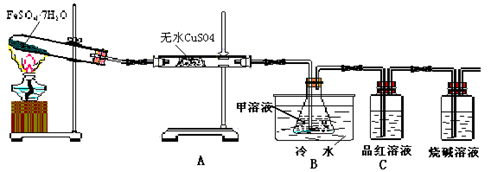
(1)用于检验SO2气体的装置是 (填装置的字母),确认水蒸气存在的现象是 ;
(2)利用装置B可以确认的产物是 ,装置B中的甲溶液可选(填序号) ,
①足量澄清石灰水 ②足量氯化钡溶液 ③足量硝酸钡溶液
该装置中冷水的作用是 ;
(3)为探究Fe2O3的性质和用途,取试管中少许固体溶于适量盐酸中制备饱和铁盐溶液,将此饱和溶液逐滴加入沸水中加热片刻,观察液体的颜色变为 ,检验该分散系的最简方法为 。
(1)C(2分),无水CuSO4白色粉末变为蓝色(2分);
(2)SO3,(2分)②(2分),SO3与H2O的反应是放热反应,降低温度有利于SO3被水吸收。(2分)
(3)红褐色液体(2分) 丁达尔效应(2分)
考查物质的检验
(1)通过C装置中的品红溶液的褪色来检验SO2的存在,装置A中的无水硫酸铜变蓝色可用于检验水蒸气的存在
(2)由于SO3的熔点较高,在冰水冷凝下会冷凝为晶体,故利用装置B可以确认SO3的生成;
由于SO2、SO3均为酸性氧化物,均可与澄清石灰水产生浑浊,排除①;
SO3可与硝酸钡溶液得到硫酸钡沉淀,SO2可被硝酸钡溶液中的NO3—在酸性情况下氧化为SO42—,进而也可得到硫酸钡沉淀,故排除③;
故选择②:氯化钡溶液来检验的存在:SO2不与氯化钡溶液反应,但SO3可产生白色沉淀硫酸钡
(3)Fe2O3可溶于盐酸得到FeCl3饱和溶液,将此饱和溶液逐滴加入沸水中加热片刻,可得到氢氧化铁胶体,呈红褐色,一般通过丁达乐效应来检验

