(2011年福建龙岩,12题)利用工业煤制乙二醇(重要的化工原料),因具有低成本、低能耗、低排放等特点而具有非常广阔的前景,该制备过程如图所示。回答下列问题:

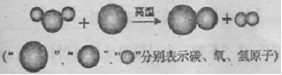
(1)“造气”过程的微观示意图如下,则制备合成气的化学方程式为 。
(2)合成气有还原性,可用于冶炼钢铁。请写出合成气与Fe2O3反应的一个化学方程式: 。
(3)合成气在不同催化剂作用下,可以合成不同的物质。仅用合成气为原料不可能得到的物质是 (填字母序号)。
A、草酸(HOOCCOOH) B、甲醇(CH3OH) C尿素[CO(NH2)2]
(4)从煤直接作燃料到用煤制取乙二醇,你得到的启示是 。
(1)C+H2O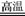 CO+H2
CO+H2
(2)3H2+Fe2O3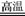 2Fe+3H2O 或3CO+Fe2O3
2Fe+3H2O 或3CO+Fe2O3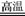 2Fe+3CO2
2Fe+3CO2
(3) C (4) 化学能指导人类合理利用资源(其他合理答案也可)
分析:(1)利用图示中相关的物质的结构判断其化学式并书写出相关的方程式.
(2)由于合成气是氢气与一氧化碳均具有还原性都能置换出氧化铁中的铁.
(3)依据质量守衡定律的应用解答此题.
(4)从体现化学知识的重要性分析即可.
解答:解:(1)由图示可知反应前是水的分子与碳原子反应后是一氧化碳的分子与氢气分子,可书写出化学方程式.
(2)氢气与一氧化碳均具有还原性都能置换出氧化铁中的铁,同时生成水和二氧化碳,结合方程式的书写解决即可.
(3)由质量守恒定律可知化学反应前后元素的种类不变,可知反应前元素有三种即碳氢氧,反应后不会出现氮元素,所以尿素不可能产生.
(4)从煤直接作燃料到用煤制取乙二醇,是一种节能环保的方式,因此体现了化学知识的重要性.
故答案为:(1)C+H2O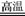 CO+H2(2)Fe2O3+3H2
CO+H2(2)Fe2O3+3H2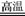 2Fe+3H2O或Fe2O3+3CO
2Fe+3H2O或Fe2O3+3CO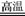 2Fe+3CO2(3)C(4)化学能指导人类合理利用资源(其他合理答案也可)
2Fe+3CO2(3)C(4)化学能指导人类合理利用资源(其他合理答案也可)
