(物质结构与性质)新型节能材料高温超导体的最先突破是在1987年从新的钇钡铜氧材料的研究开始的.在制备钇钡铜氧高温超导体的同时,偶然得到了副产品--紫色的硅酸铜钡.凑巧的是,后者正是发现于中汗代器物上的被称为“汗紫”的颜料,还发现于秦俑彩绘.
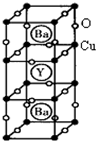
钇钡铜氧的晶胞结构如图.研究发现,此高温超导体中的铜元素有两种价态,+2价和+3价.
(1)给出铜在周期表中的位置(周期和族)______
(2)写出Cu3+的核外电子排布:______
(3)根据图示晶胞结构,推算晶体中Y,Cu,Ba和O原子个数比,确定其化学式为:______
(4)根据(3)所推出的化合物的组成,计算出其中Cu原子的平均化合价(该化合物中各元素的化合价为Y3+、Ba2+),最后计算化合物中这两种价态Cu原子个数比为:______.
(5)在硫酸铜溶液中通入过量的氨气,小心蒸发,最终得到的[Cu(NH3)4]SO4晶体中含有的化学键除了普通共价键外,还有______和______.
(1)Cu的原子序数为29,核外电子排布式为1s22s22p63s23p63d104s1,应位于周期表第四周期,IB族,
故答案为:第四周期,IB族;
(2)Cu的电子排布式为1s22s22p63s23p63d104s1,失去3个电子后,Cu3+的电子排布式为[Ar]3d8 或1s22s22p63s23p63d8,
故答案为:[Ar]3d8 或1s22s22p63s23p63d 8;
(3)由晶胞结构示意图可知,晶胞中,有1个Y3+,2个Ba2+位于晶胞内部,则平均一个晶胞含有:1个Y3+,2个Ba2+,
铜离子(二价和三价)位于顶点和棱的位置,则共含有铜离子个数为:8×
+8×1 8
=3,1 4
O2-位于棱以及面心位置,处于棱上的氧离子共有12个,处于面心的氧离子共有8个,则平衡1个晶胞含有氧离子的个数为:12×
+8×1 4
=7,则化学式为YBa2Cu3O7,1 2
故答案为:YBa2Cu3O7;
(4)根据化合价代数和为0可知,Cu的平均化合价为+
=+2×7-3-2×2 3
,7 3
设晶胞平均含有x个Cu2+,ygCu3+,
则有:x+y=3 2x+3y=2×7-3-2×2
解之得x=2,y=1,
所以:Cu2+:Cu3+=2:1,
故答案为:Cu2+:Cu3+=2:1;
(5)[Cu(NH3)4]SO4晶体中,)[Cu(NH3)4]2+与SO42-之间为离子键,Cu2+与NH3之间为配位键,
故答案为:离子键,配位键.
