为了预防碘缺乏病,有关部门规定食盐中的碘含量(以I计)应在20~50 mg/Kg。制备KIO3的方法如下:
方法1:6I2+11KClO3+3H2O=6KH(IO3)2+5KCl+3Cl2↑;KH(IO3)2+KOH=2KIO3+H2O
方法2:碱性条件下,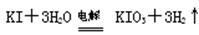
方法3: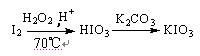
⑴与方法3相比方法1的不足是 ,方法2的不足是 。
⑵方法2选用的电极是惰性电极,则其阳极反应式是 。
⑶方法3反应温度控制在70℃左右,不采用更高温度的主要原因是 。
⑷制备纯净KIO3的实验步骤中,最后需将所得晶体最好使用 洗涤2~3次,干燥后得产品。
⑸已知:KIO3+5KI+3H2SO4=3K2SO4+3I2+3H2O; I2+2S2O32-=2I-+S4O62-。为测定加碘食盐中碘的含量,设计的方案如下。请完善实验步骤并计算测定结果:
I2+2S2O32-=2I-+S4O62-。为测定加碘食盐中碘的含量,设计的方案如下。请完善实验步骤并计算测定结果:
a.准确称取w g食盐于锥形瓶中,再加适量蒸馏水使其完全溶解。
b. 。
c.向锥形瓶中滴加2.0×10-3 mol/L Na2S2O3标准溶液至终点。
d.重复上述实验两次。
三次实验的数据记录如下表。则所测加碘食盐样品中的碘元素含量是 mg/kg(以含w的代数式表示)。
| 滴定次数 | 盛标准Na2S2O3溶液的读数 | |
| 滴定前刻度(/mL) | 滴定后刻度(/mL) | |
| 1 | 1.02 | 11.03 |
| 2 | 2.00 | 11.99 |
| 3 | 0.20 | 10.20 |
⑴方法一生成氯气有污染,方法二消耗大量电能;(各1分)
⑵I-+ 6OH-—6e-= IO3-+3H2O (2分)
⑶H2O2分解,I2升华(答到两个要点给满分) (2分)
⑷冰水或无水乙醇(或乙醚与乙醇混合液等) (2分)
⑸用稀硫酸酸化所得溶液,加入过量KI溶液,再滴加2-3滴淀粉溶液。 (2分)
1 270/3w
