(16分)某课外活动小组利用下图装置探究SO2与Na2O2的反应。
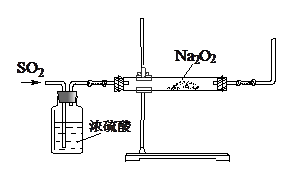
(1)请指出该装置中一个不合理的地方: 。
(2)第1小组同学认为Na2O2与SO2反应类似CO2与Na2O2的反应,该反应的化学方程式为 。
(3)第2小组同学认为Na2O2与SO2反应除了生成Na2SO3和O2外,还有Na2SO4生成。他们作出这个推断的理由是 。
(4)第3小组在通入过量SO2后,请你完成对反应完毕后硬质玻璃管中的固体成分的探究。
限选用的试剂:蒸馏水、稀盐酸、稀硫酸、稀硝酸、浓盐酸、浓硫酸、浓硝酸、Ba(NO3)2溶液、BaCl2溶液、1moL·L-1NaOH、0.01mol·L-1KMnO4、紫色石蕊试液。
①提出对玻璃管中固体成分的合理假设:
假设Ⅰ:全部为Na2SO3;
假设Ⅱ:为Na2SO3和Na2SO4的混合物;
假设Ⅲ: ;
②设计实验方案(不要在答题卡上作答)。
③实验过程
根据②的实验方案,请在答题卡上写出实验步骤以及预期现象和结论。
| 实验步骤 | 预期现象和结论 |
| 步骤1:用药匙取少量固体于试管中,加入适量蒸馏水充分溶解后,将所得溶液分置于A、B试管中。 | |
| 步骤2: | |
| 步骤3: |
(16分)
(1)缺少了尾气吸收装置。
(2)2SO2+2Na2O2=2Na2SO3+O2↑
(3)Na2O2具有强氧化性,会将SO2氧化
(4)全部为Na2SO4
| 实验步骤 | 预期现象和结论 |
| 步骤1: | |
| 步骤2:向A试管中滴加1~2滴0.01 mol·L-1 KMnO4溶液。 | 如果KMnO4溶液不褪色,则假设Ⅲ成立。 如果KMnO4溶液褪色,则假设1或2成立; |
| 步骤3:向B试管中加入足量1 mol·L-1盐酸,再滴加1~2滴0.1mol·L-1BaCl2溶液 | 如果不出现白色沉淀则假设Ⅰ成立。 如果出现白色沉淀,且步骤2中KMnO4溶液褪色,则假设Ⅱ成立。 |
