(16分)某化学研究性小组同学提出回收含铜电缆废料中提取铜的两种方案,并向老师咨询,老师就以下几个方面与同学们展开讨论:
方案甲:
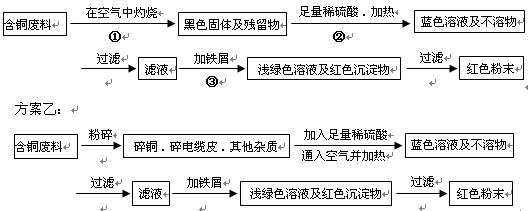
(1)两个方案哪个符合当前生产的绿色理念,为什么?
.
(2)写出方案甲中的②③步骤与铜有关的离子反应的离子方程式。
 __________________ _ __________
__________________ _ __________
_________________ _________。
(3)老师建议,无论是甲还是乙的方案,在“加铁屑”这一步时,应该加入略过量的铁屑,目的是: 。
(4)老师请同学们用化学方法检验红色粉末中是否含有过量的铁屑。请你填写下列表格写出实验操作、预期实验现象、结论及操作(②中相关的离子方程式)。
| 序号 | 实验操作 | 实验现象 | 结论及离子方程式 |
| ① | 取适量的样品于试管内 | —— | —— |
| ② | 用滴管滴入足量硫酸溶液,并充分振荡试管 | ||
| ③ | 溶液先黄色,滴入KSCN溶液后显红色 | ||
研究小组按老 师的建议完成上面操作步骤,获得晶体后对其进行检测
师的建议完成上面操作步骤,获得晶体后对其进行检测
①先取a g的晶体进行脱水实验,获得无水固体为(a—1.26)g
②将无水固体溶于足量的水配成溶液后滴加1.00mol/L的氯化钡溶液,当滴加10.00mL溶液时,沉淀恰好完全。研究小组通过计算测知该晶体的化学式是 。
(16分)
(1)乙 (1分)
甲方案第一步“灼烧”会产生污染空气的气体、粉尘、烟雾 (1分)
(2)② CuO + 2 H+="==" Cu2+ + H2O (1分)
③ Fe + Cu2+ ="==" Fe2+ + Cu (1分)
(3)确保Cu完全置换出来 (2分)
(4)(每空2分,一个要点1分,共 8分)
| 序号 | 实验操作 | 实验现象 | 结论 |
| ① | —— | —— | |
| ② | 样品部分溶解,并有气泡放出 | 样品含过量的铁屑 Fe + 2H+ = Fe2+ + H2↑ | |
| ③ | 将试管静止,将上层清液倾倒于另一试管中,先滴入少许硝酸溶液,再滴入几滴KSCN溶液 | Fe2+被硝酸氧化成Fe3+,遇SCN—呈现血红色 |
