问题
填空题
同类晶体物质熔沸点的变化是有规律的,试分析下列两组物质熔点规律性变化的原因:
| 物质 | A | NaCl | KCl | CsCl |
| 熔点/K | 1074 | 1049 | 918 | |
| 物质 | B | Na | Mg | Al |
| 熔点/K | 317 | 923 | 933 |
答案
离子 离子键 金属 q(Na+)<q(Mg2+)<q(Al3+) r(Na+)>r(Mg2+)>r(Al3+) k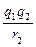 F(Na)<F(Mg)<F(Al)
F(Na)<F(Mg)<F(Al)
A组为离子晶体,离子之间通过离子键相连,强度可借助库仑定律比较:F=k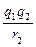 ,由于NaCl、KCl、CsCl中的阴、阳离子所带电荷数相等,而r(Na+)<r(K+)<r(Cs+),所以有:F(NaCl)>F(KCl)>F(CsCl),故熔点是逐渐降低的。
,由于NaCl、KCl、CsCl中的阴、阳离子所带电荷数相等,而r(Na+)<r(K+)<r(Cs+),所以有:F(NaCl)>F(KCl)>F(CsCl),故熔点是逐渐降低的。
B组为金属晶体,是由金属键相互结合而成的,因为q(Na+)<q(Mg2+)<q(Al+),而r(Na+)>r(Mg2+)>r(Al3+),所以,F(Na)<F(Mg)<F(Al),故其熔点是逐渐升高的。
