问题
计算题
现有A、B、C三种物质,A为气态氢化物,分子式为RH3,含R为82.4%,B是另一种气态氢化物,A+B→C,C与碱液共热放出A。C的水溶液加入稀HNO3酸化后,滴入AgNO3溶液,产生不溶性的白色沉淀,完成下列问题:
(1)写出A的名称和电子式,并指出它是否是极性分子?其稳定性比PH3、H2O强还是弱?
(2)写出B的名称和电子式,并指出它是否是极性分子?其稳定性比HF、H2S、HBr如何?其水溶液的酸性比HF、HBr、H2S如何?
(3)写出C的名称和电子式,具体指明C物质中各部分的化学键,指出C形成的晶体类型。
(4)写出上述有关的化学方程式或离子方程式。
答案
(1)氨,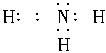 ,极性分子。稳定性:H2O>NH3>PH3。
,极性分子。稳定性:H2O>NH3>PH3。
(2)氯化氢,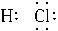 ,极性分子。稳定性:HF>HCl>HBr>H2S。酸性:HBr>HCl>H2S>HF。
,极性分子。稳定性:HF>HCl>HBr>H2S。酸性:HBr>HCl>H2S>HF。
(3)氯化铵, ,N—H极性键,
,N—H极性键,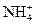 与Cl-形成离子键,离子晶体。
与Cl-形成离子键,离子晶体。
(4)NH3+HCl NH4Cl,NH4Cl+NaOH
NH4Cl,NH4Cl+NaOH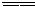 NaCl+NH3↑+H2O,
NaCl+NH3↑+H2O, N +OH-
N +OH-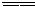 NH3↑+H2O,NaCl+AgNO3
NH3↑+H2O,NaCl+AgNO3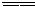 AgCl↓+NaNO3,Cl-+Ag+
AgCl↓+NaNO3,Cl-+Ag+ AgCl↓。
AgCl↓。
根据A的分子式及R的含量可知:A为NH3。(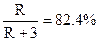 ,
,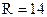 )。根据C与碱液共热放出NH3,可知C为铵盐,则B为HCl。
)。根据C与碱液共热放出NH3,可知C为铵盐,则B为HCl。
