下面的装置是仿照工业上制备硫酸的工艺流程设计出来的,用于探究工业上为何采用98.3%的浓硫酸吸收三氧化硫.
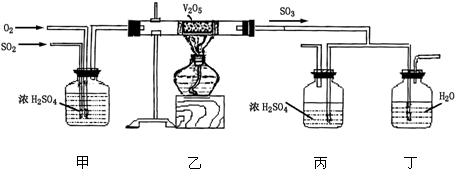
请回答下列问题:
(1)写出沸腾炉内煅烧黄铁矿的化学方程式______;
(2)上图中的乙、丙分别相当于工业上制取硫酸设备中的______、______;
(3)丁中的现象为______;
(4)下图是压强对SO2平衡转化率的影响:
| 转化率% 压强/MPa 温度/℃ | 0.1 | 0.5 | 1 | 10 |
| 400 | 99.2 | 99.6 | 99.7 | 99.9 |
| 500 | 93.5 | 96.9 | 97.8 | 99.3 |
| 600 | 73.7 | 85.8 | 89.5 | 96.4 |
(1)工业接触法制硫酸三步骤:第一步:SO2的制取,第二步:SO3的制取,第三步:硫酸的生成;第一步是黄铁矿的燃烧,化学方程式为4FeS2+11O2
2Fe2O3+8SO2, 高温 .
故答案为:4FeS2+11O2
2Fe2O3+8SO2; 高温 .
(2)装置乙是把生成的二氧化硫催化氧化,相当于工业上制取硫酸设备中的接触室,装置丙相当于工业上制取硫酸设备中的吸收塔.故答案为:接触室;吸收塔;
(3)工业生成中吸收三氧化硫用98.3%的浓硫酸,用水吸收容易形成酸雾影响吸收效果;故答案为:有酸雾;
(4)工业上利用2SO2(g)+O2(g)═2SO3(g),△H=-98.3kJ•mol-1反应制备SO3,该反应为可逆反应,正方向为体积减少的放热反应,从化学平衡移动条件分析应该采用低温高压有利于生成三氧化硫;增大压强可以使二氧化硫的转化率增大;而根据表格中提供的数据发现,压强的增加引起SO2转化率的变化并不明显,所以工业上直接采用常压;同时反应中使用催化剂,为了使催化剂的催化活性最强,根据表格中提供的数据应该采用400℃~500℃;故答案为:增大;常压下SO2的转化率已很大.
