(14分)a、b、c、d、e、f、g为七种由短期周期元素构成的粒子,它们都有10个电子,其结构特点如下:
| 粒子代码 | a | b | c | d | e | f | g |
| 原子核数 | 单核 | 单核 | 双核 | 多核 | 单核 | 多核 | 多核 |
| 电荷数(单位电荷) | 0 | 1+ | 1- | 0 | 2+ | 1+ | 0 |
试写出:
(1)a粒子的核外电子排布式 __________________________________________。
(2)b与e相应元素的最高价氧化物对应水化物的碱性强弱比较为:_______>_______ (用化学式表示)。
(3)d溶于水的电离方程式______________。
(4)g粒子所构成的晶体类型属______________。
(5)c粒子是___________,f粒子是___________ (用化学式表示)。
(1)1s22s22p6 (2)NaOH Mg(OH)2 (3)NH3+H2O NH3·H2O
NH3·H2O
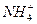 +OH- (4)分子晶体 (5)OH- H3O+
+OH- (4)分子晶体 (5)OH- H3O+
10电子的粒子有:
分子 离子
一核10电子 Ne O2-、F-、Na+、Mg2+、Al3+
二核10电子 HF OH-
三核10电子 H2O 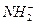
四核10电子 NH3 H3O+
五核10电子 CH4 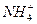
显然结合题目所给其他条件可知a为Ne,b为Na+,c为OH-,d为NH3,e为Mg2+,f为H3O+,g为H2O,至此题目所涉及的其他问题可解。
