在体积恒定的密闭容器中,1mol A(g)与1mol B(g)在催化剂作用下加热到500℃发生反应:A(g)+nB(g)
C(g)+D(g);△H>0达到平衡,下列判断正确的是( )催化剂
A.升高温度v正增大,v逆减小,平衡向正反应方向移动
B.平衡后再加入l mol B,上述反应的△H增大
C.当n<1时,通人惰性气体,压强增大,平衡向逆反应方向移动
D.若n=1且A的转化率为50%,则平衡常数等于1
A、升高温度,化学反应速率加快,v正增大,v逆增大,平衡向正反应方向移动,故A错误;
B、增加反应物B的量,会使化学平衡正向移动,但是反应的△H不变,故B错误;
C、通人惰性气体,体积不变,各组分的浓度不变,平衡不移动,故C错误;
D、A(g)+B(g)
C(g)+D(g)催化剂
初始浓度:1 V
0 01 V
变化浓度:1 2V 1 2V 1 2V 1 2V
平衡浓度:1 2V 1 2V 1 2V 1 2V
可以得出平衡常数K=
=1,故D正确.[C][D] [A][B]
故选D.

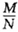 ,其中N的含义是()。
,其中N的含义是()。