(8分)
(1) 体积相同,pH相同的盐酸和醋酸溶液分别与足量的颗粒大小相同的锌粒反应,开始时产生氢气的速率_____________,充分反应后,产生氢气的量_____________(相同、盐酸的多、醋酸的多)
(2) 在一定量的盐酸溶液中加入足量的锌粒,若使产生氢气的量保持不变,但反应速率加快,可加入__________晶体,要使产生氢气的量不变,但反应速率减慢,可加入____________晶体。
可选择的晶体有:
A.纯碱
B.烧碱
C.胆矾
D.醋酸钠 (E) KHSO4(3)某研究小组拟用定量的方法测量Al和Fe分别与酸反应的快慢,设计了如下图1所示的装置。
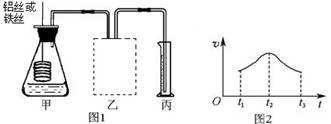
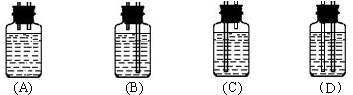
在虚线框内连接合适的装置___________________
②若要比较产生气体的快慢,可以测量相同时间段内产生气体的体积,也可以测量____________________________________。
③实验测得铝丝产生气体的速率(v)与时间(t)的关系如图2所示,则t1~t2时间段内反应速率逐渐加快的主要原因是__________________________________。
(8分)
(1)一样,醋酸多
(2)C;D
(3)①B ②产生相同体积的气体所需时间 ③反应放热,溶液温度升高
考查弱电解质的电离、条件对反应速率的影响
(1)pH相同的盐酸和醋酸溶液中c(H+)相同,故与足量的颗粒大小相同的锌粒反应,开始时产生氢气的速率相同;
随着H+不断的被消耗,由于弱酸可电离出H+,故最终醋酸中得到的氢气多
(2)氢气的量由H+的量决定,而反应速率与外界条件有关;
故使产生氢气的量保持不变,但反应速率加快,可向溶液中加入胆矾,置换出的铜与锌形成原电池,加快产生氢气的速率,但H+的总量不变,氢气的总量也不会改变;
要使产生氢气的量不变,但反应速率减慢,可加入醋酸钠,由于CH3COO-可与溶液中的H+结合:CH3COO-+H+ CH3COOH,H+浓度减小,反应速率减慢,但随其总量并不减小
CH3COOH,H+浓度减小,反应速率减慢,但随其总量并不减小
(3)①通过排水法来测定气体的体积,需要短管进,长管出,故选择B装置
②由反应速率的概念可知,它的大小决定与单位时间内反应物或产物浓度的改变值,故还可通过测量产生相同体积的气体所需时间来判定快慢
③在本实验中,反应速率与温度与浓度有关,开始阶段,反应放热,加快了反应速率,但随着反应的进行,氢离子浓度逐渐减小,反应结束阶段,反应又逐渐减小。
