某化学小组以苯甲酸为原料制取苯甲酸甲酯,并用制得的苯甲酸甲酯进行碱性水解的实验。
I.制取苯甲酸甲酯:已知有关物质的沸点如下表:
| 物质 | 甲醇 | 苯甲酸 | 苯甲酸甲酯 |
| 沸点/℃ | 64.7 | 249 | 199.6 |
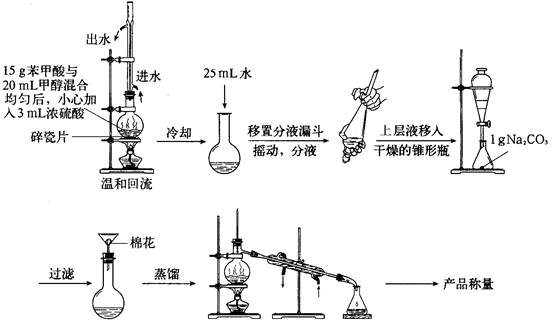
(1)简述第一步混合液体时,最后加入浓硫酸的理由是
。
若反应产物水分子中有同位素18O,写出能表示反应前后18O位置的化学方程式:
。
(2)分液时上层液体从 出来;接受馏分时温度控制在 。
(3)此制取过程比教材中乙酸乙酯的制备复杂很多,写出用此过程制备苯甲酸甲酯的两大优点: 、 。
II、苯甲酸甲酯碱性水解
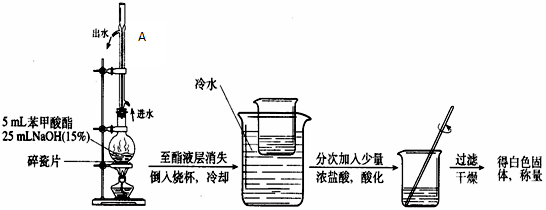
(4)写出苯甲酸甲酯碱性水解的化学反应方程式 。
(5)写出苯甲酸甲酯碱性水解实验装置中A的作用 。
III、苯甲酸甲酯有多种同分异构体
(6)符合下列条件的结构
①可以发生银镜反应②属于芳香族化合物③不具备其它环状结构④不能与FeCl3发生显色反应;共有 种。
(16分)(1)浓硫酸密度较大,且与苯甲酸、甲醇混合放出大量热量,甲醇易挥发;(2分) C6H5CO18OH+CH3OH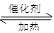 C6H5COOCH3+H218O 。(2分)
C6H5COOCH3+H218O 。(2分)
(2)分液漏斗的上口;199.6℃左右。(各2分)(3)产率高;纯度高。(2分)
(4)C6H5COOCH3 + NaOH → C6H5COONa + CH3OH。(2分)
(5)冷凝回流。(2分) (6)12 (2分)
I(1)浓硫酸密度较大,且与苯甲酸、甲醇混合放出大量热量,为确保实验的安全所以采用最后加入浓硫酸,再加上甲醇的沸点低易挥发;
酯化反应的特点是:酸脱羟基醇脱氢,所以其反应机理为:
(2)分液时,上层液体应从分流漏斗的上口倒出,下层液体应从分流漏斗的下口倒出。
根据苯甲酸甲酯的沸点可知,接受馏分时温度控制在199.6℃左右
(3)这样操作可以使反应物尽可能多的转化为生成物,使反应物得到充分反应,且生成的产物更纯。
II:(4)酯的水解反应是酯化反应的逆反应,且酯在碱性条件下水解较彻底
C6H5COOCH3 + NaOH → C6H5COONa + CH3OH
(5)该装置中冷管的作用为冷凝回流
III(6)共12种,如下图所示
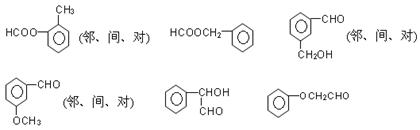
能发生银镜反应的物质有:醛类、甲酸、甲酸某酯、甲酸盐、还原性糖等。
