某同学设计了一个简单的实验(如图所示),以测定镁铝合金中铝的质量分数。可供选用的试剂有:浓H2SO4、浓硝酸、6 mol·l-1 NaOH溶液。
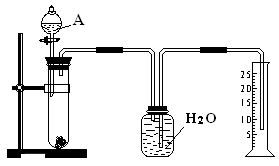
请填写下列空白
(1)有关实验操作:a、往试管中放入适量的铝合金样品;b、从分液漏斗往试管中加入过量的A溶液;c、检查装置的气密性;d、测定收集到的水的体积。正确的操作顺序是
(2)A中可选用的溶液是
(3)实验中发生反应的化学方程式为
(4)若实验中测得样品的质量为W g ,氢气的体积为aL (标准状况),则样品中Al的质量分数为
(1) c a b d
(2)6 mol·l-1NaOH溶液
(3)2Al+2NaOH+2H2O===2NaAlO2+3H2 ↑
(4)9a/11.2w × 100%
综合题目信息及装置可看出,金属与溶液A生成了不溶于水的气体,通过排水法来测定气体的体积,进一步计算出铝的质量分数
(1)首先检验装置的气密性,再以先加固体、再加液体的顺序加试剂,最后测定排出的水的体积
(2)常温下铝与浓硝酸、浓硫酸发生钝化,而镁与两酸溶液产生的气体(SO2、NO2)或可溶于水,或可与水反应,故排除浓硝酸、浓硫酸;只有6 mol·l-1 NaOH溶液符合题意
(3)2Al+2NaOH+2H2O=2NaAlO2+3H2 ↑
(4)由上述方程式可计算出铝的质量为:
