某学生为了测定部分变质的Na2SO3样品的纯度,设计了如下实验:
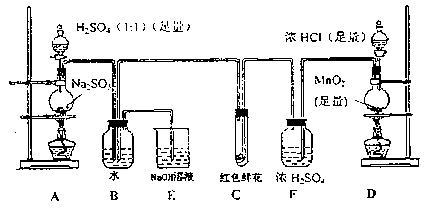
回答下列问题:
(1)写出A装置中玻璃仪器的名称:酒精灯、_____________、_____________。
(2)写出D中的化学方程式: ;实验开始后,写出B中反应的离子方程式_____。
(3)C中的现象是______,E装置的作用是____________________________。
(4)称取25.2g的Na2SO3样品放入A装置的烧瓶中,滴入足量的H2SO4完全反应。然后将B中完全反应后的溶液与足量的BaCl2溶液反应,过滤、洗涤、干燥,得白色沉淀23.3g,则原样品中Na2SO3的纯度为________%
(5)要使测定结果准确应先点燃______处酒精灯(填装置字母)待看到出现 现象时,再通入______
(10分)(1)圆底烧瓶(1分)、分液漏斗(1分),
MnO2+4HCl(浓) =MnCl2+Cl2↑+2H2O(1分)
SO2+ Cl2+ 2H2O =SO42-+ 4H++ 2Cl-(1分),(3)鲜花褪色(1分);吸收多余氯气防污染(1分)50%(1分)D;(1分)黄绿色(1分)SO2(1分)
综合题目信息、所给装置药品可看出,通过衡量B中所生成的沉淀的质量来测定样品纯度;
(1)A装置是制取SO2的发生装置:Na2SO3+2H2SO4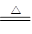 Na2SO4+SO2↑+2H2O,所用玻璃仪器包括:酒精灯、圆底烧瓶、分液漏斗
Na2SO4+SO2↑+2H2O,所用玻璃仪器包括:酒精灯、圆底烧瓶、分液漏斗
(2)D装置是制取Cl2的发生装置:MnO2+4HCl(浓) =MnCl2+Cl2↑+2H2O;
B装置中两气体相遇:SO2+Cl2+2H2O=SO42-+4H++2Cl—
(3)干燥的氯气与鲜花中的水分生成次氯酸,它具有漂白性,可使鲜花褪色;E装置可吸收多余的Cl2,防止污染空气
(4)由关系式Na2SO3→SO2→SO42-→BaSO4可知,样品中Na2SO3的质量为0.1×126=12.6g,原样品中Na2SO3的纯度为12.6/25.2=50%
(5)为了保证SO2完全被氧化,则应先点燃D外酒精灯,提前生成氯气,等B装置中出现黄绿色的气体时,再通入SO2
