为探究铜与浓硫酸的反应,某兴趣小组进行了如下实验。
【实验1】铜与浓硫酸反应,实验装置如图所示。
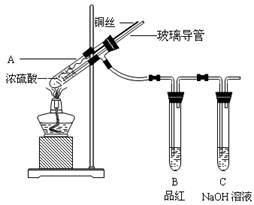
(1)、装置A中发生反应的化学方程式为:
(2)、熄灭酒精灯后,因为有导管存在,B中的液体不会倒吸,其原因是: 。
拆除装置前,不打开胶塞,为了使装置中的残留气体完全被吸收,应当采取的操作是: 。
【实验2】实验中发现试管内除了产生白色固体外,在铜丝表面还有黑色固体甲生成,甲中可能含有氧化铜、氧化亚铜、硫化铜、硫化亚铜。
查阅资料:
①氧化亚铜在酸性环境下会发生自身氧化还原反应生成Cu2+和铜单质,在空气中充分煅烧,可以转化为氧化铜。
②硫化铜和硫化亚铜常温下都不溶于稀盐酸,在空气中充分煅烧,均转化为氧化铜和二氧化硫。
为了研究甲的成分,该小组同学在收集到足够量的固体甲后,进行了如下实验:
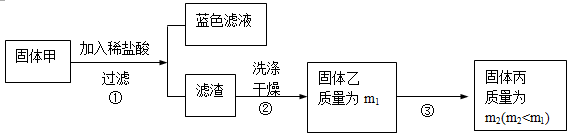
(3)、步骤②中检验滤渣是否洗涤干净的实验方法是: 。
(4)、固体乙在空气中煅烧时,使用的实验仪器除了玻璃棒、三脚架、酒精灯外,还必须有:
。
(5)、确定乙是否煅烧完全的操作是: 。
(6)、煅烧过程中一定发生的化学反应方程式为: 。
高氯酸铵(NH4ClO4)是复合火箭推进剂的重要成分,实验室可通过下列反应制取:
NaClO4(aq)+NH4Cl(aq)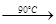 NH4ClO4(aq)+NaCl(aq)
NH4ClO4(aq)+NaCl(aq)
(7)、用氨气和浓盐酸代替NH4Cl,上述反应不需要外界供热就能进行,其原因是:
。
(8)、反应得到的混合溶液中NH4ClO4和NaCl的质量分数分别为0.30和0.l5(相关物质的溶解度曲线如下图)。从混合溶液中获得较多NH4ClO4晶体的实验操作依次为(填操作名称)蒸发浓缩, ,过滤, 、干燥。
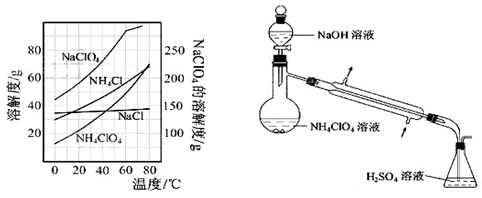
为了测定样品中NH4ClO4的含量,装置如上图所示(加热装置、仪器固定装置已略去),实验步骤如下:

(9)、步骤3中,准确取用24.00 mL H2SO4(aq)的玻璃仪器是 。
(10)、实验中确保生成的氨被稀硫酸完全吸收的实验步骤是 (填写步骤编号)。
(11)、必须重复实验2~3次,其原因是 。
(12)、如果0.320 g试样中含NH4ClO4的准确值为0.095g,而实验测定结果是0.092g。该实验
的相对误差为 。
Cu+2H2SO4(浓)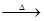 CuSO4+SO2↑+2H2O (2分)
CuSO4+SO2↑+2H2O (2分)
试管A中气体压强减小,空气可以通过导管进入试管A中保持A中压强不变(1分);从导
管口向A中大量鼓气(1分)
取最后一次洗涤液于试管中,滴加硝酸银溶液,若无白色沉淀产生,说明沉淀洗涤干净;若有白色沉淀生成,则说明未洗干净。(操作1分,结论1分,共2分)
泥三角、坩埚(坩埚钳)(2分,坩埚钳不写不扣分)
重复操作(再煅烧、冷却、称量),直至恒重(前后两次称量差不超过0.001g)。(2分)
2CuS+3O2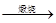 2CuO+2SO2 。(2分)
2CuO+2SO2 。(2分)
氨气与浓盐酸反应放出热量 (2分)
冷却结晶、冰水洗涤(1分1答,共2分)
滴定管 (1分)
1、5、6 (1分1答,共3分)
使实验结果准确(减少实验误差)(2分)
-3.16% (2分)
(1) Cu+2H2SO4(浓) 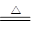 CuSO4+SO2↑+2H2O
CuSO4+SO2↑+2H2O
(2) 试管A中气体压强减小,空气可以通过导管进入试管A中保持A中压强不变;
从导管口向A中大量鼓气
(3) 取最后一次洗涤液于试管中,滴加硝酸银溶液,若无白色沉淀产生,说明沉淀洗涤干净;若有白色沉淀生成,则说明未洗干净。
(4)泥三角、坩埚、坩埚钳
(5) 再煅烧、冷却、称量,直至恒重,前后两次称量差不超过0.1g。
(6) 2CuS+3O2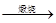 2CuO+2SO2
2CuO+2SO2
(7) 氨气与浓盐酸反应放出热量
(8) 从混合溶液中获得较多NH4ClO4晶体的实验操作依次为(填操作名称)蒸发浓缩, 冷却结晶、过滤,洗涤、干燥。
(9) 酸式滴定管
(10)实验中确保生成的氨被稀硫酸完全吸收的实验步骤是1、5、6
(11) 必须重复实验2~3次,其原因是减少实验误差
(12) 该实验的相对误差为【(0.095g—0.093)/0.095g】×100%≈3.16%
