(12分)鸡蛋壳中含有大量钙、少量镁和钾等元素。实验室可用图示流程测定鸡蛋壳中钙、镁元素含量。依据的反应可以表示为:Ca2++Y2-=CaY、Mg2++Y2-=MgY。回答下列问题。
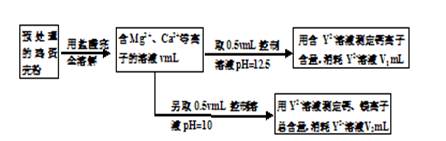
(1)测定Ca2+、Mg2+总含量时,控制溶液pH=10。若pH过大,测定结果将 (填“偏大”、“偏小”或“无影响”);
(2)测定Ca2+含量的关键是控制溶液的pH,使溶液中Mg2+形成沉淀,若要使溶液中c(Mg2+)不大于1.2×10-7mol/L,则溶液pH应不小于 (已知:Ksp[Mg(OH)2]=1.2×10-11,上述实验均在室温下进行)。
(3)如果鸡蛋壳粉质量为mg,溶液中Y2+浓度为c mol/L,则鸡蛋壳样品中镁元素质量分数是 。
(4)有同学提出可采用如下装置、通过测定鸡蛋壳与盐酸反应产生的二氧化碳的量就能测定鸡蛋壳中的钙的总含量。
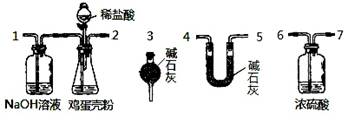
①采用该方法进行实验,各装置从左到右的连接顺序依次:
1—2—__ ________________(填各装置对应接口的数字序号)。
②若排除实验仪器和操作的影响因素,此实验方法测得的结果是否准确?
答:________(填“准确”、“不一定准确”或“无法判断”)。
原因是___________________ __
。
(12分)(1)偏小(2分) (2)12 (2分) (3)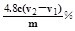 (3分)
(3分)
(4)①6—7—4—5—3或6—7—5—4—3(2分)②不一定准确。
(1分)如果蛋壳中钙元素全部以碳酸钙形式存在,且不再含有能与盐酸反应产生酸性气体的其他物质,则测定结果准确;否则不准确。
(开放性试题,只要合理均酌情给分)(2分)
(1)如果pH过大,会生成Mg(OH)2沉淀,从而使消耗Y2-的体积偏小,测定结果偏小;
(2)Ksp=c2(OH-)c(Mg2+),c(OH-)= 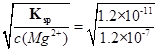 =0.01mol/L,故pH不小于12;
=0.01mol/L,故pH不小于12;
(3)镁消耗Y2-的体积为(V2-V1)ml,n(Mg2+)=c×(V2-V1)×10-3mol,m(Mg2+)=c×(V2-V1)×10-3×24g;故质量分数为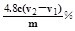
(4)①反应→干燥(浓硫酸)→吸收CO2(碱石灰)→防止空气中水、二氧化碳进入;故答案为6—7—4—5—3或6—7—5—4—3;
②不一定准确,不能保证钙元素全部以碳酸钙形式存在,且不再含有能与盐酸反应产生酸性气体的其他物质,则测定结果准确;否则不准确。
