问题
填空题
现有一包白色固体混合物,可能由BaCl2、KOH、KNO3、MgCl2、CuSO4中的一种或几种混合而成,某课外兴趣小组的同学进行如下图所示实验:
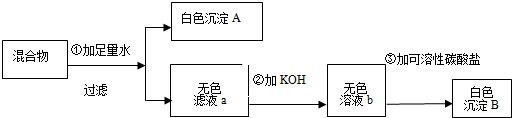
试回答:
(1)生成白色沉淀A的化学方程式______.
(2)白色沉淀B的化学式______.
(3)上述实验中,还不能确定的物质是______.
(4)②加KOH溶液的目的是______.
答案
混合物溶于水产生白色沉淀和无色滤液,因此固体中一定没有硫酸铜,因为硫酸铜溶于水是蓝色;氢氧化钾与氯化镁反应产生氢氧化镁白色沉淀,因此一定含有氢氧化钾和氯化镁;无色滤液a中加入氢氧化钾溶液没有沉淀产生,说明氯化镁已完全反应,在无色滤液b中加入可溶性碳酸盐能产生白色沉淀,故固体中一定含有氯化钡,钡离子与碳酸根离子结合成碳酸钡白色沉淀.
(1)由上述分析可知固体中一定含有氯化镁和氢氧化钾,二者发生反应产生白色沉淀氢氧化镁,化学方程式为
MgCl2+2KOH=Mg(OH)2↓+2KCl
(2)由上述分析可知白色沉淀B为碳酸钡,化学式为 BaCO3
(3)硝酸钾在整个过程中没有涉及到,因此不能确定是否含有硝酸钾;
(4)②加KOH溶液的目的是验证无色滤液中是否含有氯化镁,排除加入可溶性碳酸盐产生碳酸镁沉淀的干扰.
故答案为:MgCl2+2KOH=Mg(OH)2↓+2KCl BaCO3 KNO3 确认无色滤液a中已没有氯化镁(其他答案合理均可给分)
