(17分)某同学受2Mg+CO2  2MgO+C的启发,用如图所示的装置进行Mg和SO2的实验。
2MgO+C的启发,用如图所示的装置进行Mg和SO2的实验。
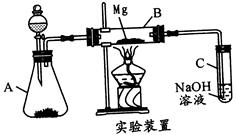
(1)选择制取SO2的合适试剂:_____________。
①10%的H2SO4溶液 ②80%的H2SO4溶液 ③Na2SO3固体 ④CaSO3固体
(2)写出装置B中发生的主要反应的化学方程式:____________
(3)有同学认为本实验应在镁下方垫一不锈钢片,理由是______________
(4)你认为该装置是否有不足之处?__________如果有,请列出两点:_________、________。
(5)对于反应后试管C中的成份某同学提出如下假设:
假设①全部是NaSO3 假设②全部是NaHSO3
假设③_____________________ 假设④_____________________
请补充完善假设。并将下表实验检验设计及结论补充完整。
| 实验操作 | 预期现象 | 结论 |
| (1)取少许反应后试管C中的溶液加入足量的BaCl2溶液 | 无白色沉淀产生 | 证明假设_______是正确的 |
| (2)若有白色沉淀产生再检测(1)的上层溶液的PH | 若PH>7 | 证明__________正确 |
| 若PH=7 若PH<7 | 证明__________正确 证明__________正确 |
(1)②③(1分)
(2)3Mg+SO2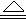 2MgO+MgS (2Mg+2SO2
2MgO+MgS (2Mg+2SO2 2MgO+S Mg+S
2MgO+S Mg+S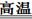 Mgs) (2分)
Mgs) (2分)
(3)SiO2是酸性氧化物 所以Mg与玻璃中的SiO2能发生反应,故不能直接接触(2分)
(4)有(1分) 在A与B之间未连接一干燥装置;C装置未与大气相通
未放设计防倒吸装置(写两点即可)(2分)
(5)Na2SO3和NaHSO3的混合物 (1分) NaSO3和NaOH的混合物(1分)
假设①正确。(2分)
若 PH > 7 则溶液是Na2SO3和NaOH的混合物(1分)
PH < 7 则说明是NaHSO3的Na2SO3的混合物(1分)
PH=7 则说明是Na2SO3(1分)
(1)实验室制取SO2,常用亚硫酸钠固体和浓硫酸反应,所以答案选②③。
(2)根据2Mg+CO2  2MgO+C可知,镁和SO2反应生成物应该是氧化镁和单质硫,由于在高温下镁还可以继续和硫反应生成硫化镁,所以方程式为3Mg+SO2
2MgO+C可知,镁和SO2反应生成物应该是氧化镁和单质硫,由于在高温下镁还可以继续和硫反应生成硫化镁,所以方程式为3Mg+SO2 2MgO+MgS。
2MgO+MgS。
(3)由于玻璃中含有二氧化硅,而SiO2是酸性氧化物因此Mg能与玻璃中的SiO2能发生反应,所以不能直接接触。
(4)由于在高温下镁也能与水蒸气反应,而生成的SO2没有干燥,所以应该在在A与B之间未连接一干燥装置;SO2易溶于水,导管口直接插入氢氧化钠溶液中易造成倒吸。
(5)由于亚硫酸是二元酸,与氢氧化钠反应可以生成正盐,也可以生成酸式盐。所以根据题意两种。例外设应该是Na2SO3和NaHSO3的混合物和NaSO3和NaOH的混合物。亚硫酸钠能和氯化钡反应产生沉淀,所以如果没有产生沉淀,则没有亚硫酸钠。由于氢氧化钠是强碱,亚硫酸氢钠溶于水显酸性,所以可以通过测定上层清液的pH值来进一步鉴别。即若 PH > 7 则溶液是Na2SO3和NaOH的混合物;PH < 7 则说明是NaHSO3的Na2SO3的混合物;PH=7 则说明是Na2SO3。
