(12分)在室温下,化学反应I–(aq) + OCl–(aq) = OI–(aq) + Cl–(aq)的反应物初始浓度、溶液中的氢氧根离子初始浓度及初始速率间的关系如下表所示:
| 实验编号 | I–的初始浓度 (mol·L-1) | OCl–的初始浓度 (mol·L-1) | OH–的初始浓度 (mol·L-1) | 初始速率v (mol·L-1· s-1) |
| 1 | 2 × 10–3 | 1.5 × 10–3 | 1.00 | 1.8 × 10–4 |
| 2 | a | 1.5 × 10–3 | 1.00 | 3.6 × 10–4 |
| 3 | 2 × 10–3 | 3 × 10–3 | 2.00 | 1.8 × 10–4 |
| 4 | 4 × 10–3 | 3 × 10–3 | 1.00 | 7.2 × 10–4 |
①为了实施实验1,某同学取5mL0.02mol·L-1碘化钾溶液、5mL0.015 mol·L-1次氯酸钠溶液、40mL某浓度氢氧化钠溶液混合反应。则该氢氧化钠溶液物质的量浓度为 ________________(2分)
②实验2中,a= (2分)
③设计实验2和实验4的目的是 ;(2分)
④计算b、c值:b= ;c= (4分)
⑤若实验编号4的其它浓度不变,仅将溶液的酸碱值变更为pH = 13,反应的初始速率v= 。(2分)
(1)1.25mol/L(2)4×10-3(3)探究OCl-浓度对反应初始速率的影响,解出b
(4)b=1 c=-1 (5)v=7.2×10-3 mol·L-1·S-1
(1)因为碘化钾的浓度是0.02mol/L,而混合后是0.002mol/L,所以混合后溶液的体积是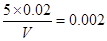 ,解得V是50ml。所以碱的体积是50ml-5ml-5ml=40ml,因此
,解得V是50ml。所以碱的体积是50ml-5ml-5ml=40ml,因此
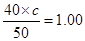 ,解得c=1.25mol/L。
,解得c=1.25mol/L。
(2)将实验2中的有关数据代入v=" k" [I–]1 [OCl–]b [OH–]c可得,a=4×10-3mol/L。
(3)实验2和实验4相比不同的是Ocl-的初始浓度,实验目的是探究OCl-浓度对反应初始速率的影响。
(4)将实验1和实验4的数据分别代入v=" k" [I–]1 [OCl–]b [OH–]c可得,b=1。同样将实验3和实验4的有关数据代入v=" k" [I–]1 [OCl–]b [OH–]c可得c=-1。
(5)pH = 13,则c(OH-)=0.1mol/L。所以V=k [I–]1 [OCl–]b [OH–]c=[I–]1 [OCl–]b ×(0.1)-1。又因为k[I–]1 [OCl–]b×(1)-1=7.2 × 10–4,解得v=7.2×10-3 mol·L-1·S-1。
