(18分)下图为某套实验装置示意图,无法看到实验说明,加热装置已经省略。
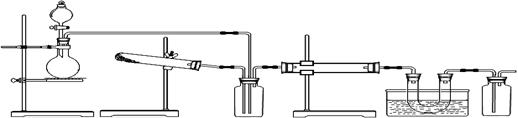
A B C D E F
甲同学认为此套装置用于合成物质X, D处盛放V2O5,E处冰水冷却的U型管中有固体X出现。
(1)事实上此装置所附实验说明符合甲同学的推断,那么X的化学式是 ,C装置中盛放的液体药品是 。
(2)甲同学方案中为了提高A装置产物的转化率,可以增大B装置产物的通入量。要知道A、B两个装置产物的通入量哪个大,可通过观察 得知。
(3)若F装置中盛放的药品是 。本实验有无不妥之处?如有请答出改进方案;若无,此问可不答_ 。
乙同学认为此套装置用于合成物质Y,D处盛放铂铑合金网,E处冰水冷却的U型管中有红棕色气体Y生成且越接近U型管底部颜色越浅。对于A处,乙认为没有加热装置。
(4)若要用上述装置完成乙同学所认为的实验,C处所起作用与合成X时最初所起作用一致,那么C处的广口瓶应改为 ,所装药品为 。
(5)写出乙同学认为的D装置中发生反应的化学方程式 。
(6)为什么此时U型管中的红棕色气体越接近管底颜色越浅?
(18分每空2分)(1)SO3,浓硫酸。(2)C装置中哪个导管冒出气泡的速率快。(答案合理均给分)
(3)98.3%H2SO4溶液;F装置后再增加一个内盛碱液的洗气装置。
(或碱石灰; 将F装置改为干燥管。
或NaOH浓溶液;在F装置前再增加一个内盛浓硫酸的洗气装置)(答案合理均给分)
(4)U型管(或干燥管);碱石灰。(答案合理均给分)
(5) 。
。
(6)因为2NO+O2=2NO2,2NO2(红棕) N2O4(无色),本反应是放热反应,U型管底部的温度降低,上述可逆平衡向右移动,NO2浓度降低,颜色变浅。
N2O4(无色),本反应是放热反应,U型管底部的温度降低,上述可逆平衡向右移动,NO2浓度降低,颜色变浅。
(1)V2O5常用作合成三氧化硫的催化剂,所以X是三氧化硫。合成三氧化硫的原料是氧气和二氧化硫,但在进入装置D之前需要干燥,故C装置中盛放的液体药品是浓硫酸。
(2)气体通过溶液时会冒气泡,所以可通过观察气泡的快慢来控制反应速率。
(3)因为三氧化硫极易吸水,为防止空气中的水分进入需要在F装置中盛放浓硫酸。因为生成三氧化硫的的反应是可逆反应,而二氧化硫属于大气污染物,因此需要在F装置后再增加一个内盛碱液的洗气装置。
(4)铂铑合金网常用来氨的催化氧化,红棕色气体Y是NO2。因为氨气极易溶于水,所以不能用液体干燥剂,故需要将广口瓶改为U型管,用碱石灰作干燥剂。
(5)氨催化氧化的方程式为 。
。
(6)因为NO2气体中存在平衡2NO2(红棕) N2O4(无色),本反应是放热反应,U型管底部的温度降低,上述可逆平衡向右移动,NO2浓度降低,颜色变浅。
N2O4(无色),本反应是放热反应,U型管底部的温度降低,上述可逆平衡向右移动,NO2浓度降低,颜色变浅。
