问题
实验题
(8分)某小组查阅资料得知:C2O42-+MnO4-+H+→ CO2↑+Mn2++H2O(未配平),欲利用该反应测定某草酸钠(Na2C2O4)样品中草酸钠的质量分数。该小组称量1.34 g草酸钠样品溶于稀硫酸中,然后用0.200 mol·L-1的酸性高锰酸钾溶液进行滴定(其中的杂质不跟高锰酸钾和稀硫酸反应)。
(1)滴定前是否要滴加指示剂? (填“是”或“否”),请说明理由 。
(2)滴定时用 (填a或b)滴定管盛装KMnO4标准溶液。

(3)达到终点时消耗了15.00 mL的高锰酸钾溶液,样品中草酸钠的质量分数为 。
答案
(1)否 ,KMnO4溶液呈紫色,达滴定终点紫色不再褪去。
(2)b (3)75%
(1)用高锰酸钾溶液滴定草酸溶液时由于高锰酸钾本身是紫色的所以不需要再加入指示剂。
(2)高锰酸钾溶液具有强氧化性所以应该装在酸式滴定管中,所以选b.
(3)反应消耗的高锰酸钾的的物质的量为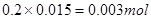 ,反应的化学方程式配平后为 5C2O42-+2MnO4-+16H+→10 CO2↑+2Mn2++8H2O,根据高锰酸钾可以计算出草酸根离子的物质的量为
,反应的化学方程式配平后为 5C2O42-+2MnO4-+16H+→10 CO2↑+2Mn2++8H2O,根据高锰酸钾可以计算出草酸根离子的物质的量为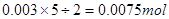 ,草酸钠的物质的量为0.0075mol,所以草酸钠的质量为
,草酸钠的物质的量为0.0075mol,所以草酸钠的质量为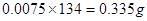 ,样品中草酸钠的质量分数
,样品中草酸钠的质量分数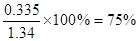 。
。
