(16分)文献资料显示某地区的酸雨主要为硫酸型和盐酸型酸雨。某兴趣小组对酸雨进行实验研究。
(1)提出合理的假设:该酸雨中的溶质除H2SO4、HC1外,该小组同学根据硫酸型酸雨的形成过程,预测主要溶质还一定有 。
(2)设计实验方案验证以上假设。在答题卡上写出实验步骤、预期现象和结论。
限选试剂及义器:盐酸、硝酸、BaC12溶液、Ba(OH)2溶液、AgNO3溶液、紫色石蕊试液、品红溶液、烧杯、试管、胶头滴管。
(3)酸雨部分组成测定:
①滴定:准确量取25.00mL该酸雨于锥形瓶中,加入几滴淀粉溶液,将0.02000mol·L—1 碘水装入50mL酸式滴定管,滴定终点现象为 ,记录数据,重复滴定2次,平均消耗碘水VmL。
②计算:被碘水氧化的物质的物质的量浓度之和为 (只列出算式,不做运算)
(16分)
(1)SO2(或H2SO3)
(2)每空2分
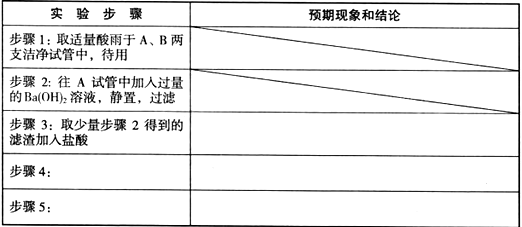
| 实验步骤 | 预期现象和结论 |
| 步骤3: | 若滤渣不完全溶解,则酸雨中含硫酸 |
| 步骤4:取适量步骤2得到的滤液,先加入过量的硝酸,然后加入AgNO3溶液 | 若产生白色沉淀,则酸雨中含盐酸 |
| 步骤5:往B试管中加入少量品红溶液,振荡 | 若品红溶液褪色,则酸雨中含亚硫酸或SO2 |
①溶液出现蓝色,且半分钟不褪色
②0.02V/25mol/L
(1)硫酸型酸雨,SO2+H2O=H2SO3,2H2SO3+O2=2H2SO4;形成过程中可能产生SO2、H2SO3;
(2)设计实验验证(1)中的假设,含H2SO4、HC1、SO2、H2SO3;检验C1-:加硝酸酸化的硝酸银溶液,产生白色沉淀;检验SO2,用品红溶液;检验SO42-,用Ba2+;
(3)H2SO3+I2+H2O=2HI+H2SO4;H2SO3和I2为1:1反应;
