(12分)某研究小组将V1 mL 1.0 mol/L HCl溶液和V2 mL未知浓度的NaOH溶液混合均匀后测量并记录溶液温度,实验结果如下图所示(实验中始终保持V1+V2=50 mL)。回答下列问题:

(1)研究小组做该实验时环境温度 (填“高于”、
“低于”或“等于”)22 ℃,判断的依据是 。
(2)由题干及图形可知,V1︰V2= 时,酸碱恰好完全中和,此反应所用NaOH溶液的浓度应为 mol/L。
(3)实验时将酸碱在简易量热计中混合,并用 搅拌,使溶液混合均匀。经有关计算知此反应共放出Q kJ的热量,请写出此反应的热化学方程式: 。
(1)低于;5mLHCl溶液和45mLNaOH溶液反应放热后的温度已经是22 ℃,则溶液混合前的实验环境温度一定低于22 ℃
(2)3︰2;1.5mol·L-1(3)环形玻璃搅拌棒;H+(aq) + OH-(aq)=H2O (aq)△H =" -100" Q / 3 kJ·mol-1或HCl(aq) + NaOH(aq)=NaCl(aq)+H2O (l)△H =" -100" Q /3 kJ·mol-1(每格2分)zx
(1)根据图像可知5mLHCl溶液和45mLNaOH溶液反应放热后的温度已经是22 ℃,所以溶液混合前的实验环境温度一定低于22 ℃。
(2)只有当恰好反应时放出的热量才最多。由图像知当盐酸的体积是30ml时,放热最多,因此V1︰V2等于3︰2。根据反应式H++OH-=H2O,反应所用NaOH溶液的浓度应为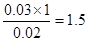 mol/L。
mol/L。
(3)为了防止热量的损失,不能用金属棒搅拌,而应用环形玻璃搅拌棒。因为反应中实际生成水0.03mol,所以此反应的热化学方程式为H+(aq) + OH-(aq)=H2O (aq)△H =" -100" Q / 3 kJ·mol-1。
