(选做题)(21分)下表是元素周期表的一部分,表中所列的字母分别代表一种化学元素。
试回答下列问题:
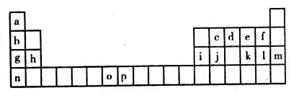
(1)元素p为26号元素,请写出其基态原子电子排布式 。
(2)d与a反应的产物的分子中中心原子的杂化形式为 。
(3)h的单质在空气中燃烧发出耀眼的白光,请用原子结构的知识解释发光的原因: 。
(4)o、p两元素的部分电离能数据列于表:
| 元素 | o | P | |
| 电离能/kJ·mol-1 | I1 | 717 | 759 |
| I2 | 1509 | 1561 | |
| I3 | 3248 | 2957 | |
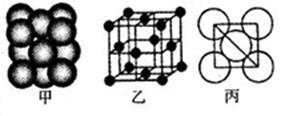
(5)i单质晶体中原子的堆积方式如下图甲所示,其晶胞特征如下图乙所示,原子之间相互位置关系的平面图如下图丙所示,则晶胞中i原子的配位数为 。
(6)元素a、c、e可形成一种相对分子质量为60的一元羧酸分子,其分子中共形成 个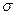 键, 个
键, 个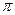 键。
键。
(7)第三周期8种元素按单质熔点高低的顺序如下图,其中电负性最大的是 (填下图中的序号)。
(8)短周期某主族元素M的电离能情况如下图所示,则M元素是述周期表的 元素(填元素符号)。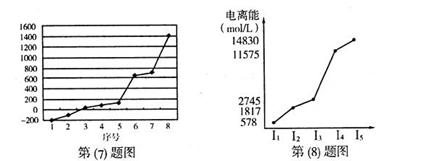
(共21分)
(1)1s22s22p63s23p43d64s2(2分)
(2)sp3(2分)
(3)电子从能量较高的轨道跃迁到能力较低的轨道时,以光(子)的形式释放能量(3分)
(4)Mn2+的3d轨道电子排布为半满状态,比较稳定(3分)
(5)12(3分)
(6)7(2分) 1(2分)
(7)7(2分)
(8)Al(2分)
