由A、B、C、D四种金属按下表中装置进行实验。
| 装置 | 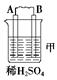 | 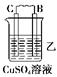 | 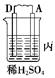 |
| 现象 | 二价金属A不断溶解 | C的质量增加 | A上有气体产生 |
(1)装置甲中电子流向是①_____________,溶液中H+向②____极移动.(用A、B填空)
装置甲中负极的电极反应式是③_____________________________________________。
(2)装置乙中B的金属性比C④_____,正极的电极反应式是⑤______________________。
(3)装置丙中A极的电极反应是⑥_______________,溶液的pH⑦________(填“变大”、“变小”或“不变”)。
(4)四种金属活泼性由强到弱的顺序是⑧_______________________________________。
(5).当丙中A极产生的气体在标准状况下为2.24L时,D极失去的电子的物质的量为⑨____________.若D为Zn,则D极质量减轻⑩_______g.
.(1) ①A→B ②B ③ A -2e-=A2+ (2)④活泼(或强) ⑤ Cu-2e-=Cu2+
(3)⑥ 2H++2e-=H2 ↑ ⑦变大 (4)⑧D>A>B>C (5)⑨0.2mol⑩6.5g
(1)金属不断溶解,说明A是负极,B是正极,金属所失去的电子经导线传递到正极B上,所以溶液中的阳离子氢离子向正极方向移动。
(2)C的质量增加,说明C是正极,B是负极,因此金属性是B大于C。溶液中的铜离子在正极得到电子,发生氧化反应。
(3)A上有气泡,说明A是正极,D是负极。溶液中的氢离子在正极得到电子发生还原反应生成氢气,氢离子浓度减小,pH增大。
(4)根据以上分析可知金属性强弱是D>A>B>C。
(5)氢气是0.1mol,转移电子是0.1mol。根据得失电子守恒可知,被氧化的锌是0.1mol,质量是6.5g。
