问题
计算题
(10分)某化学兴趣小组为了测定镁铜合金中镁的质量分数,取出3g合金样品,将60g稀硫酸分6次加入样品中,充分反应后过滤、洗涤、干燥、称重,得到的实验数据如下:
| 稀硫酸用量 | 剩余固体质量 |
| 第一次加入10g | mg |
| 第二次加入10g | 2.0g |
| 第三次加入10g | 1.5g |
| 第四次加入10g | 1.0g |
| 第五次加入10g | 0.6g |
| 第六次加入10g | 0.6g |
(2)计算合金样品中镁的质量分数。
(3)计算所用稀硫酸中H2SO4的质量分数。
答案
(1) Cu (1分) 5 (1分) 2.5 (1分) (2) 80% (3分) (3) 20.4%(3分)
(1)铜和稀硫酸不反应,所以最后剩余的是铜。根据实验2、3可知,10g稀硫酸就能溶解0.5g合金。所以m=3g-0.5g=2.5g。在实验4、5中溶解的合金质量是0.4g,这说明在第5次加入稀硫酸时样品中的镁已经完全反应.
(2)铜是0.6g,所以镁是2.4g,则镁的质量分数是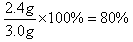
(3)10g稀硫酸就能溶解0.5g镁,所以根据方程式Mg+H2SO4=MgSO4+H2↑,10g稀硫酸中含有溶质是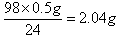 ,所以稀硫酸的质量分数是2.04g÷10.0g×100%=20.42%。
,所以稀硫酸的质量分数是2.04g÷10.0g×100%=20.42%。
