沈阳理工大学在废旧电池回收处理现状研究报告中报道了一种湿法处理方法,以下是对废旧电池材料(含有Ni(OH)2、碳粉、氧化铁和铝箔等)进行资源回收所设计的实验流程
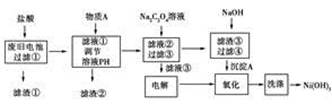
已知:①NiCl2易溶于水,Fe3+不能氧化Ni2+。
②已知实验温度时的溶解度:NiC2O4>NiC2O4·H2O>NiC2O4·2H2O
③金属离子在该实验流程下完全沉淀的pH:
| 离子 | Al3+ | Fe3+ | Ni2+ |
| pH | 5.2 | 4.1 | 9.7 |
(1)物质A 的作用是调节溶液的pH以除去杂质Fe3+和Al3+,以下最适合作为A物质的是________。
A.NiO B.盐酸 C.NaOH D.氨水
(2)滤渣②的主要成分是_________________________________。
(3)写出加入Na2C2O4溶液反应的化学方程式: _____________。
(4)写出电解滤液③的阴极反应式___________________________。
检验电解滤液③时阳极产生的气体的方法是用湿润的________试纸检验。
(5)由沉淀A生成Ni(OH)3的过程是先在滤渣③中加入过量NaOH溶液进行沉淀转化,待反应完全后再通入电解滤液③产生的气体进行氧化,请写出该氧化过程的离子方程式:__________________。
(6)如何检验Ni(OH)3是否洗涤干净?
________________________________。
(1)A
(2)Fe(OH)3 Al(OH)3
(3)NiCl2+Na2C2O4+2H2O===NiC2O4·2H2O +2NaCl
(4)2H++2e-=== H2↑ 淀粉碘化钾
(5)2Ni(OH)2+2OH -+ Cl2===2Ni(OH)3+2Cl-
(6)用试管取少量最后一次洗涤液,滴加硝酸银溶液,若没有白色沉淀生成,则说明Ni(OH)3已经洗涤干净,若有白色沉淀生成,则说明Ni(OH)3没有洗涤干净。
滤液①中的溶质是NiCl2、HCl、AlCl3、FeCl3,用NiO调节溶液的pH既可以除去杂质Fe3+和Al3+,杂质Fe3+和Al3+分别转化为Fe(OH)3和Al(OH)3,又不引入其他杂质离子。则滤液②溶质主要是NiCl2,加入Na2C2O4后生成溶解度最小的NiC2O4·2H2O,故滤液③中主要含有NaCl,滤渣③中主要含有 NiC2O4·2H2O,NiC2O4·2H2O与NaOH溶液反应转化为Ni(OH)2,Ni(OH)2被电解滤液③时阳极产生的Cl2氧化为Ni(OH)3。
