(12分)某研究性学习小组的课题为“Mg—Cu硫酸原电池电解CuCl2溶液的研究”,他们的研究装置如下图所示(C1、C2均为碳棒),按要求填写下列空格。
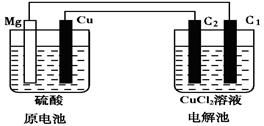
(1)铜片上的现象是 ,该极的电极反应式为 。
(2)C1极的名称为 ,C2极的电极反应式为 。
(3)下列关于该装置中电子流向的叙述中正确的是 。
A.从镁电极经导线流向C1极
B.从C1极经导线流向镁电极
C.从铜电极经导线流向C2极
D.从C2极经导线流向铜电极(4)原电池中稀硫酸的体积为200 mL ,物质的量浓度为1.5 mol·L-1,当电解池中某碳棒上产生3.36 L(标准状况)气体时,求:
① 有 个电子通过了电线(NA=6.02×1023) 。
② 此时原电池溶液中H+的物质的量浓度为 mol/L (不考虑溶液体积变化)。
(12分)有气泡生成,(1分) 2H++2e=H2↑(2分)
(2)阴极 (1分) 2Cl--2e-=Cl2↑(2分)
(3)A D(2分) (4) 1.806×1023 (2分) 1.5(2分)
(1)在原电池中较活泼的金属作负极,失去电子,发生氧化反应。电子经导线传递到正极上,所以溶液中的阳离子向正极移动,阴离子向负极移动。正极得到电子,发生还原反应。镁比铜活泼,所以镁是负极,失去电子,铜是正极,溶液中的氢离子在正极得到电子,生成氢气,方程式为2H++2e=H2↑。
(2)C1极与电源的负极相连,所以是阴极,溶液中的铜离子放电。C2极和电源的正极相连,是阳极,溶液中的氯离子在阳极失去电子,方程式为2Cl--2e-=Cl2↑。
(3)电解池中,电子经导线从阳极流向外加电源的正极,然后从原电池的负极经导线传递到电解池的阴极,所以答案选AD。
(4)①电解池中产生的气体是氯气,物质的量是3.36L÷22.4L/mol=0.15mol,所以转移电子是0.15mol×2=0.3mol,电子数是0.3mol×6.02×1023/mol=1.806×1023个。
②根据电子得失守恒可知,生成氢气是0.15mol,所以溶液中氢离子的物质的量是0.2L×1.5mol/L×2-0.15mol×2=0.3mol,所以氢离子浓度是0.3mol÷0.2L=1.5mol/L。
