.利用下图装置可测定m g纯碱样品(含少量NaCl)中Na2CO3的质量分数.
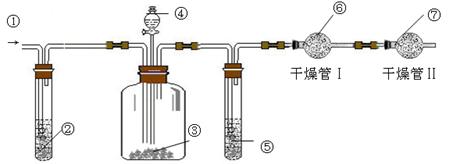
(A) (B) (C)
(1)实验中使用的药品可能有:a.浓H2SO4、b.稀硫酸、c.稀盐酸、d.纯碱样品、e.碱石灰、f.NaOH溶液、g.空气.请将这些药品的盛装部分对号入座(必要时可重复使用),请填写对应的序号:
① 、② 、③ 、④ 、⑤ 、⑥ 、⑦ .
(2)实验中使用了空气,其作用是 ;若通入空气的速度过快或通入空气的量不足,则所测定Na2CO3的含量 (填“偏高”、“偏低”或“准确”).
(3)干燥管Ⅱ的作用是 ,若缺乏干燥管Ⅱ,其后果是 .
(4)若分液漏斗中④的滴液速度过快,将导致实验结果 (填“偏高”、“偏低” 和“准确”).
(5)若干燥管Ⅰ内药品的质量实验前为m1 g,实验后为m2 g,则样品中Na2CO3的质量分数的数学表达式为 。
(1)① g ② f ③ d ④b ⑤ a ⑥ e ⑦ e
(2) 使反应产生的CO2气体充分排出;偏低
(3)防止空气中的CO2和H2O被吸入干燥管Ⅰ中。使测出的样品中Na2CO3的质量分数偏大
(4) 偏低 (5) 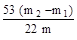 ×100%.
×100%.
(1)根据装置图可知,实验原理是利用碳酸钠和酸生成CO2,如果吸收CO2来计算碳酸钠的质量,由于生成的CO2中含有水蒸气,所以在通入碱石灰之前,还需要首先除去水蒸气。又因为装置中会残留CO2,所以还必需通入空气排尽装置的CO2。但其中也含有CO2,所以通入的可知首先要除去CO2,且还必需防止空气中的水蒸气和CO2被碱石灰吸收,所以正确顺序是① g ② f ③ d ④b ⑤ a ⑥ e ⑦ e 。
(2)根据以上分析可知,使用空气的目的是使反应产生的CO2气体充分排出;;若通入空气的速度过快或通入空气的量不足,则生成的CO2不能完全气被吸收,因此结果偏低。
(3)由于空气中也含有水蒸气和CO2,所以干燥管Ⅱ的作用是防止空气中的CO2和H2O被吸入干燥管Ⅰ中;如果没有该装置,则吸收的CO2增加,碳酸钠的质量分数会偏大。
(4)若分液漏斗中④的滴液速度过快,则碳酸钠反应不完全,生成的CO2减少,测定结果偏低。
(5)干燥管Ⅰ内药品的质量实验前为m1 g,实验后为m2 g,则生成的CO2质量是(m2-m1)g,所以碳酸钠的质量就是(m2-m1)÷44×106,因此质量分数是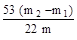 ×100%.。
×100%.。
