问题
选择题
关于下列几种离子晶体,说法不正确的是( )
A.由于NaCl 晶体和CsCl晶体中正负离子半径比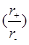 不相等,所以两晶体中离子的配位数不相等
不相等,所以两晶体中离子的配位数不相等
B.CaF2晶体中,Ca2+配位数为8,F-配位数为4不相等,主要是由于F-、Ca2+电荷(绝对值)不相同
C.MgO的熔点比MgCl2高主要是因为MgO的晶体能比MgCl2大
D.MCO3中M2+半径越大,MCO3热分解温度越低
答案
答案:D
A、正确,氯化钠配位数为6,氯化铯的配位数为8;
B、是由于电荷不相同引起的,正确。
C、离子晶体,电荷越多,半径越小,晶格能越大;
D、熔沸点与分解温度不是一回事。错误
