(13分)某化学兴趣小组的同学利用下图所示实验装置进行实验(图中a、b、c表示止水夹)。
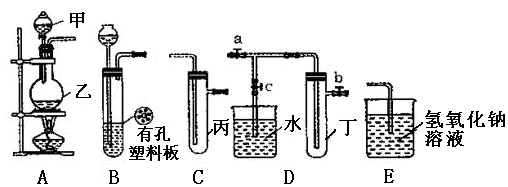
(1)甲、乙两仪器的名称是 、 。
(2)利用B装置可制取的气体有 (写出两种即可)。
(3)A、C、E相连后的装置可用于制取Cl2,写出A中发生反应的化学方程式 。
(4)B、D、E装置相连后,在B中盛装浓硝酸和铜片(铜片放在有孔塑料板上),可制得NO2并进行有关实验。
①欲用D装置验证NO2与水的反应,其操作步骤为:先关闭止水夹 ,再打开止水夹 ,使烧杯中的水进入试管丁中。
②试管丁中的NO2与水充分反应后,若向试管内缓缓通入一定量的O2,直至试管全部充满水,则所得溶液中溶质的物质的量浓度是 mol·L−1(保留2位有效数值,气体按标准状况计算)。
(13分)
(1) 分液漏斗、圆底烧瓶(2分)
(2)H2、CO2 、 H2S等 (2分)
(3)4HCl(浓)+ MnO2 MnCl2 + Cl2↑ + 2H2O (3分)
MnCl2 + Cl2↑ + 2H2O (3分)
(4)①a、b(2分); c(1分) ② 0.045 (3分)
题目分析:B装置的特征是有空的隔离板,还有长颈漏斗,相当于是简易的启普发生器,所以可以制取H2、CO2 、 H2S等;A、C、E相连后的装置可用于制取Cl2,写出A中发生反应的化学方程是4HCl(浓)+ MnO2 MnCl2 + Cl2↑ + 2H2O;欲用D装置验证NO2与水的反应,其操作步骤为:先关闭止水夹a,b,再打开止水夹c,使烧杯中的水进入试管丁中;试管丁中的NO2与水充分反应后,若向试管内缓缓通入一定量的O2,直至试管全部充满水,则所得溶液中溶质的物质的量浓度是0.045mol·L−1具体的计算过程是:
MnCl2 + Cl2↑ + 2H2O;欲用D装置验证NO2与水的反应,其操作步骤为:先关闭止水夹a,b,再打开止水夹c,使烧杯中的水进入试管丁中;试管丁中的NO2与水充分反应后,若向试管内缓缓通入一定量的O2,直至试管全部充满水,则所得溶液中溶质的物质的量浓度是0.045mol·L−1具体的计算过程是:
4NO2+O2+2H2O==4HNO3
假设试管体积是v,所以溶液体积也是v,二氧化氮体积也是v,所以由公式得:n(NO2)=n(HNO3)=v/22,4 mol c(HNO3)=n(HNO3)/v ="1/22.4" ="0.045" mol/L2的性质实验
点评:本题重点考查的是NO2的性质实验,学生只要熟练掌握试验的分析方法和与物质的量有关的计算方法,此类问题不难解决。
