某校化学兴趣小组设计了图示实验装置(图中省略了夹持仪器)来测定某铁碳合金中铁的质量分数,并探究铁与浓硫酸的反应。
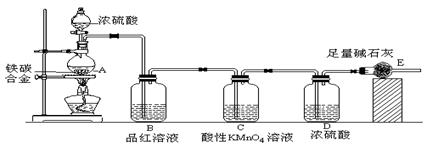
⑴ m克铁碳合金中加入过量浓硫酸,未点燃酒精灯前,A、B均无明显现象,其原因是
①常温下碳与浓硫酸不反应;② ___________________ 。
⑵写出加热时A中碳与浓硫酸发生反应的化学方程式 ______________________ 。
⑶B中的现象是: _______________________________________ ;
C的作用是: ___________________ _______________________ 。
⑷待A中不再逸出气体时,停止加热,拆下E并称重,E增重bg。则铁碳合金中铁的质量分数为 _____________ (写表达式)。
(5)反应一段时间后,用滴管吸取A中的溶液滴入到适量水中作为试样,试样中所含金属离子的成分有以下三种可能:
Ⅰ:只含有Fe3+;Ⅱ:只含有Fe2+;Ⅲ: 。
|
⑴ 常温下Fe遇浓硫酸发生钝化 ⑵ C + 2H2SO4(浓) = CO2↑ + 2SO2↑ + 2H2O
⑶ 品红溶液褪色,或“颜色变浅” 除尽反应产物中的SO2气体
⑷ (11m-3b)/11m
⑸既有Fe3+又有Fe2+
取试样少许于试管中,先滴加少量的KSCN溶液,振荡后溶液显红色证明有Fe3+ ;再取试样少许于另一支试管中,滴加少量的酸性KMnO4溶液,若浅红色褪去,证明溶液中含有Fe2+。
题目分析:常温下,铁遇浓硫酸发生钝化,炭与浓硫酸不反应;加热时,铁与过量浓硫酸生成硫酸铁、二氧化硫和水、炭与浓硫酸生成二氧化碳、二氧化硫和水。二氧化硫使品红褪色,酸性高锰酸钾溶液除去二氧化硫,浓硫酸干燥二氧化碳,二氧化碳被碱石灰吸收,由C+2H2SO4(浓)CO2↑+2SO2↑+2H2O得n(C)=n(CO2)=b/44mol,所以炭的质量分数为3b/11m,铁的质量分数为(11m-3b)/11m。反应一段时间后,A中的金属阳离子可能有Fe2+或Fe3+或Fe2+和Fe3+,检验A中存在Fe3+可用KSCN溶液,检验A中存在Fe2+可用酸性高锰酸钾溶液,Fe2+能使酸性高锰酸钾溶液褪色。
点评:本题实验装置须改进,因E中的碱石灰能吸收空气中的二氧化碳和水蒸气,所以应在E后再连一个E 装置,减少误差。
