(12分)在化学科学研究中,物质发生化学反应的反应热可通过实验测定,也可通过化学计算的方式间接地获得。
⑴实验方法测反应反应热
①中和热测定
实验中所需要使用的玻璃仪器除烧杯、量筒外还需要 、 。
为了减少实验误差:实验过程中将NaOH溶液 (选填“一次”或“分多次”)倒入盛有盐酸的小烧杯中;溶液混合后,准确读取混合溶液的 ,记为终止温度。
②实验测定在一定温度下,0.2 molCH4(g)与足量H2O(g)完全反应生成CO2(g)和H2(g)吸收33 kJ的热量。该反应的热化学方程式 。
⑵通过化学计算间接获得
①已知拆开1mol的H—H键、I—I、H—I键分别需要吸收的能量为436kJ、153kJ、299kJ。
则反应H2(g)+I2(g)=2HI(g)的反应热△H= kJ·mol-1
②工业生产甲醇的常用方法是:CO(g)+2H2(g)=CH3OH(g) △H=-90.8 kJ·mol-1。
已知:2H2(g)+ O2(g) = 2H2O (l) △H=-571.6 kJ·mol-1
H2(g)+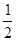 O2(g) = H2O(g) △H=-241.8 kJ·mol-1
O2(g) = H2O(g) △H=-241.8 kJ·mol-1
根据上述反应确定:H2燃烧热为 kJ·mol-1;
CH3OH(g)+O2(g) = CO(g)+2H2O(g) △H= kJ·mol-1
(12分)
⑴温度计 环形玻璃搅拌棒 一次 最高温度 (各1分)
CH4(g)+2H2O(g) =CO2(g)+4H2(g) △H=+165.0 kJ·mol-1
⑵ -9 285.8 -392.8 (每空2分)
题目分析:①中和热测定
实验中所需要使用的玻璃仪器除烧杯、量筒外还需要温度计 环形玻璃搅拌棒。
为了减少实验误差:实验过程中将NaOH溶液一次倒入盛有盐酸的小烧杯中;溶液混合后,准确读取混合溶液的最高温度,记为终止温度。
②实验测定在一定温度下,0.2 molCH4(g)与足量H2O(g)完全反应生成CO2(g)和H2(g)吸收33 kJ的热量。该反应的热化学方程式CH4(g)+2H2O(g) =CO2(g)+4H2(g) △H=+165.0 kJ·mol-1。
⑵通过化学计算间接获得
①已知拆开1mol的H—H键、I—I、H—I键分别需要吸收的能量为436kJ、153kJ、299kJ。
则反应H2(g)+I2(g)=2HI(g)的反应热△H=436kJ+153kJ-2×299kJ=-9 kJ·mol-1
②工业生产甲醇的常用方法是:CO(g)+2H2(g)=CH3OH(g) △H1=-90.8 kJ·mol-1。
已知:2H2(g)+ O2(g) = 2H2O (l) △H2=-571.6 kJ·mol-1
H2(g)+ O2(g) = H2O(g) △H3=-241.8 kJ·mol-1
O2(g) = H2O(g) △H3=-241.8 kJ·mol-1
根据上述反应确定:H2燃烧热为285.8kJ·mol-1;
CH3OH(g)+O2(g) = CO(g)+2H2O(g) △H=-△H1-△H2+2△H3=-392.8kJ·mol-1。
点评:此题要求学生熟悉中和热的测定实验:包括实验过程,实验仪器,实验数据分析等等;盖斯定律也是常考的题目,使用该定律要注意:
1、盖斯定律只适用于等温等压或等温等容过程,各步反应的温度应相同;
2、热效应与参与反应的各物质的本性、聚集状态、完成反应的物质数量,反应进行的方式、温度、压力等因素均有关,这就要求涉及的各个反应式必须是严格完整的热化学方程式。
3、各步反应均不做非体积功。
4、各个涉及的同一物质应具有相同的聚集状态。
5、化学反应的反应热(△H)只与反应体系的始态或终态有关,而与反应途径无关。
