(8分)晶体是质点(分子、离子、或原子)在空间有规则地排列的,具有整齐外形,以多面体出现的固体物质。在空间里无限地周期性的重复能成为晶体的具有代表性的最小单元,称为晶胞。一种Al-Fe合金的立体晶胞如图所示。
⑴确定该合金的化学式____________。
⑵若晶胞的边长为a nm,阿伏加德罗常数为NA,则此合金的密度为_____________g/cm3。(化为最简)
⑶取一定质量的该合金粉末溶于足量的稀NaOH溶液中,待反应完全停止后得到气体6.72 L。过滤,将残渣用蒸馏水洗净后,取其质量的十分之一,投入100mL一定浓度的稀硝酸中,恰好完全反应,共收集到气体0.672L。(气体体积均在标准状况下测定)
①计算硝酸的物质的量浓度。
②最终所得溶液中Fe3+的物质的量浓度(假设溶液体积仍为100mL)。
(1)确定该合金的化学式____________
(2)__________________g/cm3(化为最简)
(3)__________________________________________
①
____________________________
②
___________________________。
⑴Fe2Al ⑵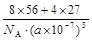 或
或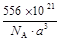
⑶①3Fe+8HNO3=3Fe(NO3)2+2NO+4H2O Fe+4HNO3=Fe(NO3)3+NO+2H2O
根据铁和稀硝酸的反应,不管铁被氧化到什么价态,均有
n(HNO3)=4 n(NO)=4×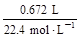 =0.12mol c(HNO3)=
=0.12mol c(HNO3)=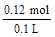 =1.2mol/L
=1.2mol/L
②2Al+2NaOH+H2O=2NaAlO2+3H2↑
开始所取合金中n(Al)=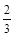 n(H2)=
n(H2)=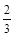 ×
×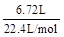 =0.2 mol
=0.2 mol
与硝酸反应的n(Fe)=0.2 mol×2× =0.04 mol
=0.04 mol
则最终所得溶液中 n(Fe2+)+n(Fe3+)=0.04 mol
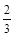 n(Fe2+)+n(Fe3+)=
n(Fe2+)+n(Fe3+)=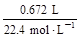 =0.03 mol(或电子守恒:2n(Fe2+)+3n(Fe3+)=3×0.03 mol)
=0.03 mol(或电子守恒:2n(Fe2+)+3n(Fe3+)=3×0.03 mol)
解得n(Fe3+)=0.01 mol c(Fe3+)=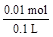 =0.1mol/L
=0.1mol/L