乙醛能与银氨溶液反应析出银。如果条件控制适当,析出的银会均匀地分布在试管壁上,形成光亮的银镜,这个反应又叫银镜反应。银镜的光亮程度与反应条件有关。某课外活动小组同学在课外活动中对乙醛的银镜反应进行了探究。
Ⅰ. 探究银镜反应的最佳实验条件部分实验数据如下表:
| 实验变量 实验序号 | 银氨溶液 /mL | 乙醛的量 /滴 | 水液温度/℃ | 反应混合液的PH | 出现银镜时间/min |
| 1 | 1 | 3 | 65 | 11 | 5 |
| 2 | 1 | 3 | 45 | 11 | 6.5 |
| 3 | 1 | 5 | 65 | 11 | 4 |
| 4 | 1 | 3 | 30 | 11 | 9 |
| 5 | 1 | 3 | 50 | 11 | 6 |
| 6 | 1 | 5 | 80 | 11 | 3 |
请回答下列问题:
(1)读表若只进行实验1和实验3,其探究目的是 。
(2)推理当银氨溶液的量为1mL,乙醛的量为3滴,水浴温度为40℃,反应混合液pH为11时,出现银镜的时间是 ;要探索不同水浴温度下乙醛进行银镜反应的最佳条件,除了测量银镜出现的时间外,还需要比较不同条件下形成的银镜的 。
(3)进一步实验 若还要探索银氨溶液的用量对出现银镜快慢的影响,如何进行实验?
。
Ⅱ. 探究对废液的回收处理:
银氨溶液放久后会变成氮化银而引起爆炸,直接排放会污染环境,且造成银资源的浪费。通过查找资料,已知从银氨溶液中提取银的一种实验流程为:
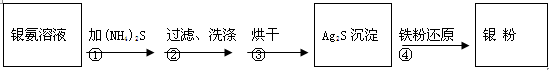
操作④的方法是:把Ag2S和铁粉放到烧杯中加浓盐酸搅拌煮沸,使Ag2S变成银粉。反应的化学方程式为:Ag2S+Fe+2HCl 2 Ag+ FeCl2+H2S↑。
2 Ag+ FeCl2+H2S↑。
(4)若获得的银粉中含有少量没有反应完的铁粉,除去铁的反应的离子方程式为: ,需要用到的玻璃仪器有 (填编号)。
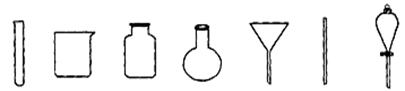
a b c d e f g
(5)操作④应在(填实验室设备名称) 中进行。
(6)要洗去试管壁上的银镜,采用的试剂是 (填名称)。
(17分)
(1)比较乙醛用量不同时生成银镜的时间(速度或质量均可)(2分)
(2)在6.5~9min之间;光亮程度(或亮度、外观、效果等合理均可给分)(各2分,共4分)
(3)保持其他的实验条件不变,改变银氨溶液的用量,测量生成银镜的时间(其它合理表述均可得分)(2分)
(4)Fe+2H+=Fe2++H2↑(2分) (其他合理答案也可给分,如Fe +2Fe3+=3Fe2+);
b e f(3分)
(5)通风橱(2分)
(6)硝酸(2分)
题目分析:(1)依题意,对比表中实验1和3,二者使用乙醛的量分别是3滴、5滴,其它条件保持不变,出现银镜时间分别为5min、4min,说明这组实验探究的目的是比较乙醛用量不同时生成银镜的时间(速度或质量);(2)依题意,实验4、2、5的探究目的是比较不同温度时生成银镜的时间(速度或质量),30℃、45℃、50℃出现银镜的时间分别为9min、6.5min、6min,由于30℃<40℃<45℃,则40℃出现银镜的时间应该介于30℃、45℃出现银镜的时间之间,即在6.5min ~9min之间;出现银镜的时间表示化学反应速率的快慢,最佳反应条件还应包括形成的银镜的光亮程度或亮度、外观、效果等;(3)根据控制变量设计实验方案的原则,应保持其他的实验条件不变,改变银氨溶液的用量,测量生成银镜的时间,以探究银氨溶液的用量对出现银镜快慢的影响;(4)由金属活动性顺序表可知,Fe>H2>Ag,则铁粉与非氧化性酸能发生置换反应,生成亚铁盐溶液、放出氢气,而银不溶于非氧化性,因此选择过量的稀盐酸除去银粉中混有的少量铁粉,即Fe+2H+=Fe2++H2↑,充分反应后过滤、洗涤得到的沉淀就是不含铁的银;溶解、过滤常常需要使用的仪器是烧杯、漏斗、玻璃棒,故bef正确;(5)铁粉还原硫化银时,由于Ag2S+Fe+2HCl 2 Ag+ FeCl2+H2S↑,反应放出的硫化氢气体有毒,因此该过程需要在通风橱中进行,多余的尾气需要用废碱液吸收处理,不能直接排入空气,以免污染环境;(6)银不溶于非氧化酸,实验室常用稀硝酸或浓硝酸氧化银,即3Ag+4HNO3(稀)=3AgNO3+NO↑+2H2O或Ag+2HNO3(浓)=AgNO3+NO2↑+H2O。
2 Ag+ FeCl2+H2S↑,反应放出的硫化氢气体有毒,因此该过程需要在通风橱中进行,多余的尾气需要用废碱液吸收处理,不能直接排入空气,以免污染环境;(6)银不溶于非氧化酸,实验室常用稀硝酸或浓硝酸氧化银,即3Ag+4HNO3(稀)=3AgNO3+NO↑+2H2O或Ag+2HNO3(浓)=AgNO3+NO2↑+H2O。
