为测定某生铁(假设仅含Fe和C)粉末状样品中铁的质量分数,某化学研究性学习小组设计有关方案进行如下实验。
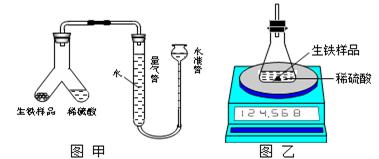
(1)设计如图甲所示装置,使生铁样品与稀硫酸反应的操作为 。
实验结束后,读出量气管中的气体体积(换算为标准状况),计算生铁样品中铁的质量分数,测定的结果偏低,可能的原因是 。(填字母序号)
A. 反应结束并冷却后,未再次调节量气管和水准管中液面相平, 即读取气体体积
B. 稀硫酸过量
C. 水准管中有少量水溢出
(2)设计如图乙所示装置,测得反应前后的有关质量如表,则生铁样品中铁的质量分数为 ,根据图中装置判断,若实验中操作没有失误,该实验结果可能 。(填“偏大”、“偏小”或 “准确”)
| 反应前:整套装置+ 稀硫酸质量/g | 反应前: 生铁样品质量/g | 反应后:整套装置+ 锥形瓶中剩余物的质量/g |
| a | m | b |
| 实验序号 | Ⅰ | Ⅱ | Ⅲ |
| 加入生铁样品的质量/g | 1.43 | 2.86 | 8.58 |
| 生成气体的体积/L(标准状况) | 0.56 | 1.12 | 2.24 |
(10分)(1)将Y型管倾斜,使硫酸溶液流入到生铁样品中。A(各1分,2分)
(2)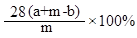 ,偏大(H2携带水蒸气逸出)(各2分,4分)
,偏大(H2携带水蒸气逸出)(各2分,4分)
(3)10:1 ,2.86 g。(各2分,4分)
题目分析:(1)要使铁样品与稀硫酸反应,就得使铁样品与稀硫酸接触,故操作为将Y型管倾斜,使硫酸溶液流入到生铁样品中。分析结果偏低的原因,A选项中比较合理,故错A。
(2)根据反应后后所得溶液质量=参加反应铁的质量+所加入的稀硫酸的质量-反应放出氢气的质量,计算生铁样品中铁的质量分数为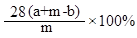 。因为H2会携带水蒸气逸出,故实验结果可能偏大。
。因为H2会携带水蒸气逸出,故实验结果可能偏大。
(3)高温下的氧气流中充分反应,Fe和C都和氧气发生反应,生成CO2气体224 mL(标准状况),即0.01mol,根据化学方程式计算得C的物质的量为0.01mol,质量为0.12g,故生铁的质量为5.72g-0.12g=5.6g,物质的量为0.1mol,故生铁粉末中铁和碳的物质的量之比为0.1mol:0.01mol=10:1。
根据表中数据计算,实验Ⅲ中生铁粉末是过量的,酸反应完,根据生成气体的体积是2.24L计算,酸的物质的量为0.1mol, 实验Ⅱ中酸是过量的,根据根据生成气体的体积是1.12L计算,酸反应了0.05mol,剩余0.05mol,故实验Ⅱ结束后的溶液中,还能溶解生铁样品的质量2.86g。
点评:本题主要考查有关化学方程式的计算和化学式的计算,难度较大,根据质量守恒定律,反应后后所得溶液质量=参加反应铁的质量+所加入的稀硫酸的质量-反应放出氢气的质量。
