我国规定饮用水质量标准必须符合下列要求:
| pH | 6.5~8.5 |
| Ca2+、Mg2+ | <0.004 5 mol·L-1 |
| 细菌总数 | <100个/mL |
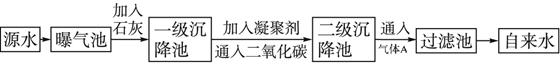
(1)源水中含Ca2+、Mg2+、HCO3-、Cl-等,加入生石灰后生成Ca(OH)2,进而发生若干复分解反应,写出其中一个离子方程式:_________________________。
(2)凝聚剂除去悬浮固体颗粒的过程____________(填序号)。FeSO4·7H2O是常用的凝聚剂,它在水中最终生成____________沉淀。
①只是物理过程 ②只是化学过程 ③是物理和化学过程
(3)通入二氧化碳的目的是________________和______________________。
(4)气体A的作用是_________________________。这种作用是基于气体A和水反应的产物具有__________性。
(5)下列物质中____________可以作为气体A的代用品。
①Ca(ClO)2 ②NH3(液) ③K2FeO4 ④SO2
(1)Ca2++HCO-3+OH-=CaCO3↓+H2O,Mg2++2OH-=Mg(OH)2↓
(2)③ Fe(OH)3 (3)调节pH 除去Ca2+
(4)杀菌消毒 强氧化 (5)①③
题目分析:(1)源水中存在Ca2+,Mg2+,HCO-3,Cl-,溶质为Ca(HCO3)2,Mg(HCO3)2,CaCl2,MgCl2,分别与Ca(OH)2发生复分解反应,化学方程式为:Ca(HCO3)2+Ca(OH)2=2CaCO3↓+2H2O;Mg(HCO3)2+2Ca(OH)2=Mg(OH)2↓+2CaCO3↓+2H2O;MgCl2+Ca(OH)2=Mg(OH)2↓+CaCl2。根据以上三个反应可以写出离子方程式:Ca2++HCO-3+OH-=CaCO3↓+H2O,Mg2++2HCO-3+2Ca2++4OH-=Mg(OH)2↓+2CaCO3↓+2H2O,Mg2++2OH-=Mg(OH)2↓。
(2)常用明矾、FeCl3溶液作源水的凝聚剂,利用Al3+或Fe3+水解成Al(OH)3或Fe(OH)3胶体吸附水中悬浮的固体颗粒,这一过程既有化学变化又有物理变化,如果用FeSO4·7H2O作凝聚剂,Fe2+发生水解:Fe2++2H2O Fe(OH)2+2H+,Fe(OH)2又迅速被氧化成Fe(OH)3:4Fe(OH)2+O2+2H2O=4Fe(OH)3,最终生成Fe(OH)3沉淀。
Fe(OH)2+2H+,Fe(OH)2又迅速被氧化成Fe(OH)3:4Fe(OH)2+O2+2H2O=4Fe(OH)3,最终生成Fe(OH)3沉淀。
(3)通入CO2的目的是调节pH和进一步除去水中的Ca2+。
(4)通入气体A用于对源水杀菌消毒,气体A必须有强氧化性。
(5)代替A气体的物质必须有强氧化性,可选择Ca(ClO)2,K2FeO4,O3等。
点评:本题主工考查源水处理成自来水的工艺流程,难度不大,侧重考查学生实验分析能力和逻辑推断能力,解题的关键是要结合题干信息,分析每一流程的作用,从而准确作答。
