实验室需要纯净的NaCl溶液,但实验室的NaCl晶体混有少量Na2SO4和NH4HCO3,某同学按如下流程图设计实验除去杂质,回答下列问题:

(1)步骤I除去的杂质是(填化学式)_______________,直接加热要好于加强碱后再进行加热,理由是 ;
(2)按流程图完成实验设计,将相关的实验操作、实验现象和实验目的填写在下表中:
| 操作步骤 | 实验现象 | 实验目的 |
| 步骤II:将残留物溶解得到溶液, | ||
| 步骤III:
|  | |
| 步骤IV:过滤,往滤液中
| ||
| 步骤V:将溶液加热煮沸 |  |
(3)若最后得到20℃的NaCl饱和溶液。已知20℃时NaCl的溶解度为36.0g、NaCl饱和溶液的密度为1.12g/cm3 ,则20℃的NaCl饱和溶液的物质的量浓度为 mol/L(计算结果保留三位有效数字)。
(17分)
(1)NH4HCO3(2分)
操作简单;节省试剂;不引入新的杂质(2分,答其中两点可得满分)
(2)(共10分,除注明外每空1分,着重号为给分点)
| 操作步骤 | 实验现象 | 实验目的 |
| 步骤II:往溶液中滴加过量的BaCl2溶液 | 生成白色沉淀 | 除去SO42-离子 |
| 步骤III:往悬浊液中(或过滤后,往滤液中)滴加过量的Na2CO3溶液 |  | 除去过量的Ba2+离子 |
| 步骤IV:滴加适量的盐酸 | 产生少量气泡 | 除去过量的CO32-离子 |
  | 驱赶溶解在溶液中的CO2和HCl气体(2分) |
(3)5.07 (3分)
题目分析:(1)铵盐不稳定,受热易分解,则加热的目的是除去固体混合物中的碳酸氢铵,NH4HCO3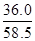 NH3↑+H2O↑+CO2↑;强碱与铵盐容易反应生成盐、氨气和水,除去旧杂质的同时,又引入新杂质,且增大试剂、操作步骤增多;(2)除去碳酸氢铵后,先将所得白色固体溶解,再向溶液中加入过量BaCl2溶液,使硫酸钠完全反应,生成白色的硫酸钡沉淀和NaCl,除去溶液中的硫酸根离子,但是引入的钡离子是新的杂质;为了除去钡离子,应向悬浊液或过滤所得滤液中加入过量碳酸钠溶液,使氯化钡完全与碳酸钠反应,生成白色的碳酸钡沉淀和氯化钠,除去溶液中的钡离子,但是引入的碳酸根离子是新的杂质;过滤,分离出硫酸钡、碳酸钡沉淀之后,为了除去滤液中的碳酸根离子,应向其中加入适量盐酸,碳酸钠与盐酸反应,生成氯化钠、二氧化碳气体和水,除去溶液中的碳酸根离子,但是引入的盐酸是新的杂质;盐酸和水的沸点较低,氯化钠的沸点高,将溶液煮沸,可以除去溶液中的氯化氢、二氧化碳和水,蒸发可得纯净的氯化钠固体;(3)依题意,36.0gNaCl溶于100g水中,即可配制20℃的饱和NaCl溶液;由于溶液的质量等于溶质质量与溶剂质量之和,则36.0gNaCl溶于100g水形成136.0g饱和NaCl溶液;由于溶液体积等于溶液质量与溶液密度的比值,则饱和NaCl溶液的体积为
NH3↑+H2O↑+CO2↑;强碱与铵盐容易反应生成盐、氨气和水,除去旧杂质的同时,又引入新杂质,且增大试剂、操作步骤增多;(2)除去碳酸氢铵后,先将所得白色固体溶解,再向溶液中加入过量BaCl2溶液,使硫酸钠完全反应,生成白色的硫酸钡沉淀和NaCl,除去溶液中的硫酸根离子,但是引入的钡离子是新的杂质;为了除去钡离子,应向悬浊液或过滤所得滤液中加入过量碳酸钠溶液,使氯化钡完全与碳酸钠反应,生成白色的碳酸钡沉淀和氯化钠,除去溶液中的钡离子,但是引入的碳酸根离子是新的杂质;过滤,分离出硫酸钡、碳酸钡沉淀之后,为了除去滤液中的碳酸根离子,应向其中加入适量盐酸,碳酸钠与盐酸反应,生成氯化钠、二氧化碳气体和水,除去溶液中的碳酸根离子,但是引入的盐酸是新的杂质;盐酸和水的沸点较低,氯化钠的沸点高,将溶液煮沸,可以除去溶液中的氯化氢、二氧化碳和水,蒸发可得纯净的氯化钠固体;(3)依题意,36.0gNaCl溶于100g水中,即可配制20℃的饱和NaCl溶液;由于溶液的质量等于溶质质量与溶剂质量之和,则36.0gNaCl溶于100g水形成136.0g饱和NaCl溶液;由于溶液体积等于溶液质量与溶液密度的比值,则饱和NaCl溶液的体积为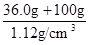 =
=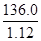 cm3=
cm3=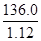 mL;溶质的物质的量等于质量与摩尔质量的比值,则136.0g饱和NaCl溶液中n(NaCl)=
mL;溶质的物质的量等于质量与摩尔质量的比值,则136.0g饱和NaCl溶液中n(NaCl)=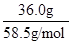 =
=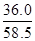 mol;由于c=n/V,则20℃的饱和NaCl溶液的物质的量浓度为
mol;由于c=n/V,则20℃的饱和NaCl溶液的物质的量浓度为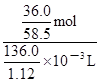 =
=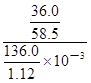 mol/L≈5.07mol/L。
mol/L≈5.07mol/L。
