某课外活动小组利用如图所示装置制取氯气。提供的试剂有:浓盐酸、饱和食盐水、氢氧化钠溶液、高锰酸钾固体。反应的化学方程式为:
2KMnO4 + 16HCl(浓)= 2KCl + 2MnCl2 + 5Cl2↑+ 8H2O
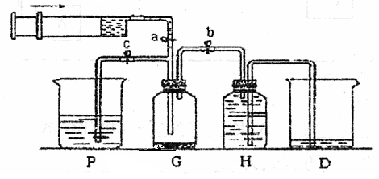
试回答下列问题:
(1)在反应2KMnO4 + 16HCl(浓)= 2KCl + 2MnCl2 + 5Cl2↑+ 8H2O中,HCl体现的性质为________和_________.当生成的Cl2的体积5.6L(标准状况下),求转移的电子的个数________(阿伏伽德罗常数用NA来表示)
(2)装置H中盛放的试剂是 。装置P中盛放的试剂是 。
(3)尾气处理时关闭弹簧夹a和弹簧夹 ,打开弹簧夹 。
(4)处理尾气时,发生反应的离子方程式为 。
(b和c各1分,其余皆为2分,共14分)
(1)酸性和还原性,0.5NA, (2)饱和食盐水,氢氧化钠溶液
(3)b c (4)Cl2+2OH-=Cl-+ClO-+H2O
题目分析:(1)在反应中,氯元素的化合价从-1价升高到0价,所以体现氯化氢的还原性。但同时还有氯化锰生成,体现氯化氢的酸性。生成氯气的物质的量是5.6L÷22.4L/mol=0.25mol,所以在反应中转移电子的物质的量是0.25mol×2=0.5mol,则转移的电子的个数是0.5NA。
(2)由于氯气能溶于水,所以可以用排饱和食盐水法收集氯气,则H中盛放的是饱和食盐水。
(3)P中盛放的氢氧化钠溶液,用来处理尾气,所以尾气处理时关闭弹簧夹a和弹簧夹b,打开弹簧夹c。
(4)氯气和氢氧化钠溶液反应的离子方程式是Cl2+2OH-=Cl-+ClO-+H2O。
点评:该题是高考中的常见题型,属于中等难度的试题,试题综合性强,难易适中。在注重对学生基础性知识考查和训练的同时,侧重对学生能力的培养和解题方法的指导与训练,有利于培养学生的严谨规范的实验设计能力,也有利于提高学生的学科素养。该类试题主要是以常见仪器的选用、实验基本操作为中心,通过是什么、为什么和怎样做重点考查实验基本操作的规范性和准确性及灵活运用知识解决实际问题的能力。
