工业上用铁屑还原法制备碘化钠的主要流程如下图:
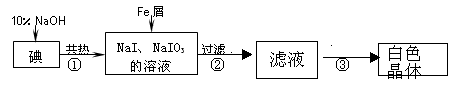
(1)碘元素位于周期表中第 周期,第 族;
(2)反应①的化学方程式 ;
(3)判断反应①中碘是否已完全反应的操作是 ;
(4)将滤液在低温下分离出NaI样品的过程中,要防止NaI被氧化,采取的措施最好是 ;
(5)某同推测步骤③中得到的白色晶体是NaI、NaIO3和NaOH的混合物,设计如下方案进行检验,实验结果表明其推测正确。
已知:IO3-十5I-+6H+=3I2+3H2O;NaIO3水溶液呈中性。
限选试剂:lmol/LH2SO4,2mol/LHNO3、淀粉溶液、酚酞试液、石蕊试液、蒸馏水。其它仪器和用品自选。
| 实验方案 | 实验现象 | 结论 |
| 将白色晶体溶于水,并滴2滴淀粉溶液 | 得到无色溶液 |  |
| 取少量溶液液于试管A中, . | 溶液显蓝色 | 溶液中含IO3一 |
| 另取少量溶液液于试管B中, . | . | 溶液中含大量0H一 |
要得到更纯的NaI,还需进一步的操作是 (填操作名称)
(16分)
(1) 五(1分);ⅦA(1分);
(2)3I2+6NaOH 5NaI+NaIO3+3H2O (2分);
5NaI+NaIO3+3H2O (2分);
(3)取少量反应液于试管中,向试管加入几滴淀粉溶液,若溶液变蓝,说明还未反应完,若无现象,说明已完全反应(2分);
(4)隔绝空气(2分);
(5)加入足量的1 mol/LH2SO4 (2分);滴入几滴酚酞溶液(2分);溶液变红(2分);重结晶. (2分)
题目分析:
(1)碘属于卤族元素,位于第五周期第VIIA族;
(2)结合流程图可知产物有NaI和NaIO3据氧化还原反应的规律可配平该歧化反应,见答案所示;
(3)判断I2是否反应就是要检验I2,具体操作位:取少量反应液于试管中,向试管加入几滴淀粉溶液,若溶液变蓝,说明还未反应完,若无现象,说明已完全反应;
(4)I-易被空气中的O2氧化,为防止其氧化,隔绝空气较好;
(5)根据题给信息可知:检验IO3-时,应该加硫酸,而不能加硝酸,因为硝酸会氧化I-为I2干扰检验IO3-;HIO3是强酸,NaIO3不水解,而HI也是强酸,NaI也不水解,溶液中OH-不是来自水解产生,可直接用酸碱指示剂来检验OH-存在;要去掉NaI中少量的NaIO3可利用NaI和NaIO3的溶解度随温度变化不同而达到分离提纯的目的的方法是重结晶(再结晶)。2的检验、方案选择、限制条件检验IO3-和OH-、分离提纯的方法选择。
