铁在冷的浓硫酸中能发生钝化现象。某兴趣小组的同学发现将一定量的铁与浓硫酸加热时,观察到铁完全溶解,并产生大量气体。为此,他们设计了如下装置验证所产生的气体。
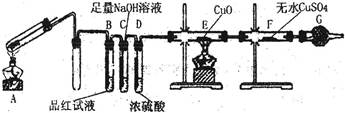
(1)证明反应所产生的气体中有SO2生成的现象是 。
(2)证明气体中含有氢气的实验现象是 。
(3)为了进一步探究反应后A溶液中铁元素的价态,他们进行了如下的假设:
假设1:溶液中铁元素既有Fe3+也有Fe2+
假设2:溶液中铁元素只有Fe3+
假设3:溶液中铁元素只有________________
基于假设1,现有试剂:0.01 mol/L酸性KMnO4溶液、稀溴水溶液、0.1 mal/L KI溶液、
淀粉溶液、KSCN溶液,蒸馏水。请探究其所得溶液。请完成表中内容。
【实验探究】
| 实验操作 | 预期现象 | 结论 |
| 取反应后的A溶液分装在a、b两试管,步骤①:往a试管中滴入 。 |
|
|
| 步骤②:往b试管中滴入 。 |
| 溶液含有Fe3+ |
(16分)(1)品红试液变浅(或褪色) (2分)
(2)E中黑色(CuO)变成红色,F中白色粉末(CuSO4)变成蓝色;(2分)
(3)假设3:溶液中铁元素只有Fe2+ (2分)
【实验探究】
| 实验操作 | 预期现象 | 结论 |
| 取反应后的A溶液分装在a、b两试管,步骤①:往a试管中滴入少量(1分)0.01mol/L酸性KMnO4溶液(1分)。 | KMnO4溶液的紫红色褪去(或变浅)(2分) | 溶液含有Fe2+(2分) |
| 步骤②:往b试管中滴入几滴(1分)KSCN溶液,充分振荡(1分)[或几滴(或少量)0.1mol/LKI溶液和淀粉溶液(1分)] 。 | 溶液变为血红色(2分) [或溶液变为蓝色(2分)] | 溶液含有Fe3+ |
题目分析:(1)SO2具有漂白性、酸性、还原性和氧化性,读图可知,该实验用品红溶液检验是否有SO2生成,若品红溶液褪色或变浅,说明装置A中反应产生的气体含有SO2;(2)氢气具有强还原性,在加热条件下能使黑色的氧化铜还原为红色的单质铜,H2被氧化为能使白色的无水CuSO4固体变蓝的H2O,若装置E中黑色固体变为红色,F中白色粉末变为蓝色,说明装置A中放出的气体中含有H2;(3)常温下铁被浓硫酸钝化,表面有一层致密氧化物薄膜,加热下强氧化性、强酸性的浓硫酸可以将铁氧化为铁盐,而过量的单质铁可以将铁盐还原为亚铁盐,因此反应后A的溶液中铁元素可能既有Fe2+又有Fe3+,也可能只有Fe3+,还可能只有Fe2+,根据已知假设1、假设2的信息推断假设3为溶液中铁元素只有Fe2+;根据铁及其化合物的性质可知,Fe2+具有还原性,能使酸性KMnO4溶液褪色,Fe3+具有氧化性,能将KI溶液还原为能使淀粉溶液变蓝的I2,Fe2+遇KSCN溶液不变红,而Fe3+遇KSCN溶液变红,大量含有Fe3+的溶液呈黄色,与溴水的颜色相同,由此可以选择适当的试剂设计实验方案验证A的溶液中既有Fe2+又有Fe3+。
