下面是一些实验室制备硫酸铜的实验设计。
实验一:用铜与浓硫酸反应制取硫酸铜。
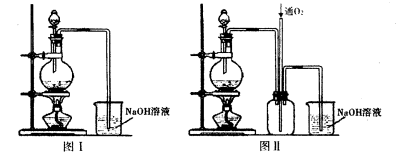
实验二:将适量浓硝酸分多次加入到铜粉与稀硫酸的混合物中,加热使之反应完全制取硫酸铜。(装置如下图中的图I.图Ⅱ)。
实验三:将铜粉在某仪器中反复灼烧,使铜粉充分与空气发生反应生成氧化铜,再将氧化铜与稀硫酸反应,经后续步骤可得到硫酸铜晶体。
实验四:向铜粉和稀硫酸的混合物中加入H2O得到硫酸铜。
请回答实验中的有关问题。
(1)实验一中发生反应的化学反应方程式为____,这种方法的缺点是____。
(2)实验二装置图中分液漏斗里盛装的液体是____。图Ⅱ是图I的改进装置,分析图II装置的优点是 。
(3)实验三中用于灼烧的仪器名称是 。该实验中的后续步骤指的是__ 。
(4)实验四中发生反应的化学方程式为____。
(5)除上面的实验设计外,请你再设计一种只用铜和稀硫酸为原料制取硫酸铜的方法(写出化学反应方程式)。
(1)Cu+H2SO4(浓) CuSO4+SO2↑+H2O(2分) 生成物对环境造成污染(1分)
CuSO4+SO2↑+H2O(2分) 生成物对环境造成污染(1分)
(2)浓硝酸(1分)①有利于氮氧化合物的吸收(1分)②防止倒吸(1分)
(3)坩埚(1分)蒸发浓缩、冷却结晶、过滤、洗涤、干燥(只要答出蒸发、结晶、过滤即给分,2分)
(4)Cu+H2O2+H2SO4=CuSO4+H2O(2分)
(5)Cu+H2SO4 CuSO4+H2↑(2分,没有电解条件不给分)
CuSO4+H2↑(2分,没有电解条件不给分)
题目分析:实验二中加入浓硝酸是提供H+,让硫酸根离子全部参与氧化还原反应。一般条件下,铜与稀硫酸不反应,必须在外加电场的作用下让其反应。所以得设计一个电解池来完成。
