(1)50 mL 0.50 mol/L盐酸与50 mL 0.55 mol/L NaOH溶液在如图所示的装置中进行中和反应。通过测定反应过程中所放出的热量可计算中和热,回答下列问题:
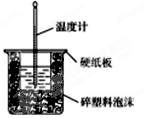
①从实验装置上看,图中尚缺少的一种玻璃用品是 。
②大烧杯上如不盖硬纸板,求得的中和热数值将________ (填“ 偏大”“偏小”或“无影响”)。
(2)酸碱中和滴定是中学化学常见实验。
某学校化学课外小组用0.2000 mol·L-1盐酸滴定未知浓度的氢氧化钠溶液,试回答下列问题。
①滴定过程中,眼睛应注视 。
②在铁架台上垫一张白纸,其目的是 。
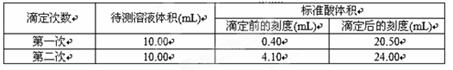
③根据下表数据,计算被测烧碱溶液的物质的量浓度是 mol·L-1。(保留四位有效数字)
④下列实验操作对滴定结果产生什么影响(填“偏高”、“偏低”或“无影响”)?
a.观察酸式滴定管液面时,开始俯视,滴定终点平视,则滴定结果________。
b.若将锥形瓶用待测液润洗,然后再加入10.00 mL待测液,则滴定结果_______。
(1)①环形玻璃搅拌棒 ②偏小
(2)① 锥形瓶内溶液颜色的变化 ②便于观察锥形瓶内液体颜色的变化,减小滴定误差 ③0.4000(保留有效数字,否则无分) ④偏高、偏高
题目分析:(1)①实验中需要搅拌,所以从实验装置上看,图中尚缺少的一种玻璃用品是环形玻璃搅拌棒。
②大烧杯上如不盖硬纸板,则会造成热量的损失,则求得的中和热数值将偏小。
(2)①滴定过程中,眼睛应注视锥形瓶内溶液颜色的变化。
②在铁架台上垫一张白纸,其目的是便于观察锥形瓶内液体颜色的变化,减小滴定误差。
③根据表中的数据可知,两次实验中消耗盐酸的体积是20.10ml和19.90ml,则消耗盐酸体积的平均值是20.00ml,所以烧碱溶液的浓度是 =0.4000mol/L。
=0.4000mol/L。
④观察酸式滴定管液面时,开始俯视,滴定终点平视。由于俯视读数偏小,所以则滴定结果偏高;若将锥形瓶用待测液润洗,然后再加入10.00 mL待测液,则消耗盐酸的体积增加,所以滴定结果偏高。
点评:化学实验常用仪器的使用方法和化学实验基本操作是进行化学实验的基础,对化学实验的考查离不开化学实验的基本操作,所以该类试题主要是以常见仪器的选用、实验基本操作为中心,通过是什么、为什么和怎样做重点考查实验基本操作的规范性和准确及灵活运用知识解决实际问题的能力。本题的难点是误差分析,需要注意实验原理,然后结合操作灵活运用即可。
