某同学对Cu的常见化合物的性质进行实验探究,研究的问题和过程如下:
(1)为探究Cu(OH)2是否和Al(OH)3一样具有两性,除选择Cu(OH)2外,必须选用的试剂为__(填序号)
a.氨水 b.氢氧化钠溶液 c.稀硫酸 d.冰醋酸
(2)为探究不同价态铜的稳定性,进行如下实验:
①将CuO粉末加热至1000℃以上完全分解成红色的Cu2O粉末,该实验说明:在高温条件下,+l价的Cu比+2价Cu更 (填“稳定”或“不稳定”)。
②向Cu2O中加适量稀硫酸,得到蓝色溶液和一种红色固体,该反应的离子化学方程式为____________,由此可知,在酸性溶液中,+1价Cu比+2价Cu更 (填“稳定”或“不稳定”)。
(3)为了探究氨气能否和氢气一样还原CuO,他根据所提供的下列装置进行实验(夹持装置未画),装置A产生氨气,按气流方向连接各仪器接口,顺序为a→____→____→____→____→____→____→h
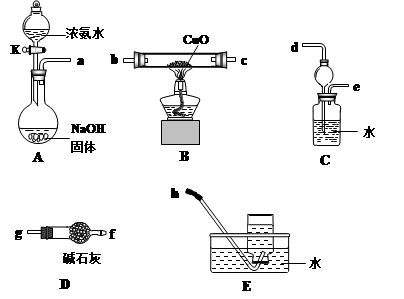
①实验开始时,打开分液漏斗的活塞K,发现浓氨水没有滴下,如果各仪器导管均没有堵塞,则可能的原因是_______________________________________。
②实验结束后,装置B中固体由黑色变为红色,装置E中收集到无色无味的气体,在空气中无颜色变化,点燃的镁条可以在其中燃烧,则B装置中发生的化学方程式为______________________。
③装置C中的球形装置的作用是_________________。
(13分,除标明1分外,其余每空均为2分。)(1)bc(对一个给1分,错一个倒扣1分)
(2)①稳定(1分);②Cu2O+2H+=Cu2++Cu+H2O,不稳定(1分) (3)g→f→b→c→d→e
①没有将分液漏斗颈上的玻璃塞打开(或使塞上的凹槽(或小孔)对准漏斗上的小孔)
②3CuO+2NH3 3Cu +N2+3H2O(没有条件扣1分) ③防倒吸(1分)
3Cu +N2+3H2O(没有条件扣1分) ③防倒吸(1分)
题目分析:(1)证明Al(OH)3呈两性的试剂是强酸和强碱,因此要想证明Cu(OH)2呈两性,也必须选强酸和强碱溶液.硫酸是强酸,所以可以选取;氢氧化钠是强碱,所以可选取;氨水是弱碱,醋酸是弱酸,均不能选择,答案选bc。
(2)①物质都有由不稳定状态转化为稳定状态的倾向,所以根据CuO粉末加热至1000℃以上完全分解成红色的Cu2O粉末可知,在高温条件下,+l价的Cu比+2价Cu更稳定。
②向Cu2O中加适量稀硫酸,得到蓝色溶液和一种红色固体,这说明氧化亚铜和稀硫酸反应生成的是硫酸铜、水和单质铜,因此该反应的离子化学方程式为Cu2O+2H+=Cu2++Cu+H2O,这说明在酸性溶液中,+1价Cu比+2价Cu更不稳定。
(3)A装置是制备氨气的,生成的氨气中含有水蒸气,需要通过碱石灰干燥。又因为氨气极易溶于水,过量的氨气在进行尾气处理时需要防止倒吸,所以正确的连接顺序是a→g→f→b→c→d→e→h。
①由于反应中由氨气生成,烧瓶内压强大,导致氨水不能滴下,即可能的原因是没有将分液漏斗颈上的玻璃塞打开(或使塞上的凹槽(或小孔)对准漏斗上的小孔)。
②实验结束后,装置B中固体由黑色变为红色,这说明有导致铜生成。装置E中收集到无色无味的气体,在空气中无颜色变化,点燃的镁条可以在其中燃烧,因此钙气体应该是氮气,所以B装置中发生的化学方程式为3CuO+2NH3 3Cu +N2+3H2O。
3Cu +N2+3H2O。
③由于氨气极易溶于水,直接通入水中吸收,容易倒吸,所以装置C中的球形装置的作用是防倒吸。
