(15分)氮化硼(BN)是一种重要的功能陶瓷材料。以天然硼砂为起始物,经过一系列反应可以得到BF3和BN,如下图所示:
请回答下列问题:
(1)由B2O3制备BF3、BN的化学方程式依次是 ;
;
(2)基态B原子的电子排布图为 ; BN中B元素的化合价为 ;
(3)在BF3分子中,F—B—F的键角是 ,B原子的杂化轨道类型为 ;
(4)已知: BF3 + NaF(过量)= NaBF4;化合物NaBF4含有的化学键类型为 ;BF4-中F—B—F的键角是 ,B原子的杂化轨道类型为 ,BF4-的立体构型为 ;
(5)在与石墨结构相似的六方氮化硼晶体中,层内B原子与N原子之间的相互作用为 ,层间作用力为 。含1 mol BN的六方氮化硼晶体中含B-N的个数为 NA。
1)(4分)B2O3+3CaF2+3H2SO4 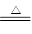 2BF3↑+3CaSO4 +3H2O ;
2BF3↑+3CaSO4 +3H2O ;
B2O3+2NH3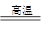 2BN+3H2O;
2BN+3H2O;
(2)(2分)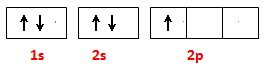 ; +3
; +3
(3)(2分)1200 , sp2;
(4)(4分)离子键、极性共价键、配位键 ; 109028, , sp3 ,正四面体;
(5)(3 分) 极性共价键 ,范德华力 ; 3。
(1)根据反应物和生成物可知,方程式分别是
B2O3+3CaF2+3H2SO4 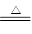 2BF3↑+3CaSO4 +3H2O、B2O3+2NH3
2BF3↑+3CaSO4 +3H2O、B2O3+2NH3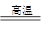 2BN+3H2O。
2BN+3H2O。
(2)根据构造原理可写出基态B原子的电子排布图。氮元素是第ⅤA,最低价是-3价,所以B元素的化合价是+3价。
(3)在BF3分子中,中心原子B原子没有孤对电子,所以其结构是平面三角形,键角是120°。其中B原子的杂化轨道类型为sp2杂化。
(4)化合物NaBF4属于钠盐,因此含有的的化学键类型为离子键和极性键。由于氟原子含有孤对电子,所以还含有配位键。同样中心原子B原子没有孤对电子,所以其结构是正四面体形,键角是109028,, B原子是sp3杂化。
(5)层内B原子与N原子之间的相互作用为极性键,而层与层之间是分子间作用力。因为B原子能形成3个B-N键,所以含1 mol BN的六方氮化硼晶体中含B-N的个数为3NA。
