无水硫酸铜在强热下会发生分解反应:
CuSO4  CuO + SO3↑ 2SO3
CuO + SO3↑ 2SO3  2SO2↑+ O2↑
2SO2↑+ O2↑
用下图所示装置(夹持仪器已略去),根据D管在反应前后的质量差计算出分解了的无水硫酸铜的质量。
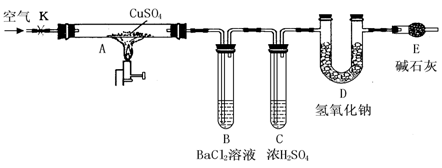
实验步骤:
①称量反应前D管的质量。
②连接好装置,关闭K,加热硬质玻璃管A一段时间后,停止加热。
③待硬质玻璃管A冷却后,打开K,通入一段时间的已除去二氧化碳等酸性气体的空气。
④再称量D管,得其反应前后的质量差为m。
回答下列问题:
(1)反应2SO3(g)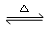 2SO2(g) + O2(g)的平衡常数表达式为K= 。
2SO2(g) + O2(g)的平衡常数表达式为K= 。
(2)B管中除温度明显升高外,还可看到的现象是 ,而温度明显升高的主要原因是 ;B管中发生反应的有关离子方程式是 。
(3)仪器E的作用是 。
(4)按上述方法实验,假设B、C、D对气体的吸收均完全,并忽略空气中CO2的影响,能否根据m计算出分解了的无水CuSO4的质量?(任选其一回答)
①如果能,则分解的无水CuSO4的质量为 (用m表示)。
②如果不能,则原因是 。为了能测得分解了的无水硫酸铜的质量,你的简单实验方案是 。
(13分)(1)K=c(O2)·c2(SO2) / c2(SO3) (1分)
(2) 有气泡冒出,产生白色沉淀(2分) SO3溶于水放热(2分)
SO3 + H2O + Ba2+= BaSO4↓+ 2H+
或SO3 + H2O = 2H++ SO42-和Ba2++ SO42-= BaSO4↓(2分)
(3)吸收空气中的水蒸气及CO2(2分)
(4)②SO3不能完全分解为SO2和O2;SO2会部分溶解在溶液中(2分)
称量装有无水硫酸铜的A管质量,强热一段时间后,冷却后再称量A管质量,根据A管在反应前后的质量差计算出分解了的无水硫酸铜的质量(2分)
题目分析:(1)平衡常数等于生成物浓度幂之积除以反应物浓度幂之积,但固体和纯液体不能写入表达式;(2)无水硫酸铜受热分解放出SO3、SO2、O2的混合气体,装置B中发生反应SO3+H2O=H2SO4,H2SO4+BaCl2=BaSO4↓+2HCl,前者放热,后者产生白色沉淀SO2、O2不能反应,则装置B中有气泡逸出,总反应式为SO3 + H2O + Ba2+= BaSO4↓+ 2H+;(3)碱石灰是NaOH和CaO组成的混合物,能吸收二氧化碳和水,防止它们进入装置D,排除空气中的水蒸气和二氧化碳的干扰;(4)不能根据装置D在反应前后的质量差m计算无水硫酸铜分解了的质量,原因是:①SO3不能完全分解为SO2和O2;②SO2会部分溶解在溶液中;正确做法是称量装有无水硫酸铜的A管质量,强热一段时间后,冷却后再称量A管质量,根据A管在反应前后的质量差计算出分解了的无水硫酸铜的质量。
