(1)某学习小组利用下图装置制取氯气并探究其性质。
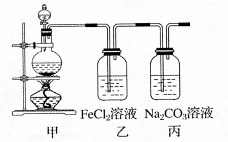
①甲装置中反应的化学方程式是 ;
②证明乙装置中FeCl2溶液与Cl2发生了反应的实验方法是(只注明试剂、现象) ;
③丙装置中通入少量Cl2,可制得某种生活中常用的漂白、消毒的物质。已知碳酸的酸性强于次氯酸,则丙中反应的化学方程式是 。
(2)有一瓶长期放置的漂白粉,请利用以下仪器和试剂,完成该漂白粉成份的探究。
试管、胶头滴管、带导管的单孔塞、蒸馏水、1mol·L-1盐酸、品红溶液、新制澄清石灰水。
【提出假设】假设一:该漂白粉未变质,含CaCl2、Ca(ClO)2;
假设二:该漂白粉全部变质,含 ;
假设三:该漂白粉部分变质,含CaCl2、Ca(ClO)2、CaCO3 。
【进行实验】在答题卡上完成下表(不必检验Ca2+、Cl-):
| 实验步骤 | 预期现象和结论 | |
| ① | 用A试管取少量澄清石灰水备用,用B试管取少量样品,再向B试管
| 若无气体放出且澄清石灰水未见浑浊,则假设一成立;
|
| ② |
|
|
(14分)
(1)①MnO2+4HCl (浓)  MnCl2+ Cl2↑+2H2O (2分)
MnCl2+ Cl2↑+2H2O (2分)
②KSCN溶液(1分);溶液变红色(1分)[或NaOH溶液,红褐色沉淀等合理答案均给分];
③Cl2+2H2O+Na2CO3=" NaCl+" NaCl+2NaHCO3(2分)
(2)CaCO3、CaCl2(2分)
(3)10-8/(a-0.1) (2分)
| 实验步骤 | 预期现象和结论 | |
| ① | 加入适量1mol/L-1盐酸(1分),塞上带导管的单孔塞,将导管另一端插入A试管中(1分) | 若有气体放出且澄清石灰水未见浑浊,则假设二或三成立[或假设三不成立] (1分) |
| ② | 用胶头滴管向上述步骤后的B试管中滴入几滴品红溶液,震荡(1分)[或另取少量样品于试管中,滴入几滴蒸馏水震荡,再滴入品红溶液] | 若品红不褪色,则假设二成立(1分);若品红褪色,假设三成立(1分) |
题目分析:
(1)①实验室制取氯气的反应:MnO2+4HCl (浓)  MnCl2+ Cl2↑+2H2O。②FeCl2溶液与Cl2发生氧化还原反应生成三价铁离子,加入KSCN溶液,溶液变红色。③由题意得:Cl2+2H2O+Na2CO3=" NaCl+" NaCl+2NaHCO3。
MnCl2+ Cl2↑+2H2O。②FeCl2溶液与Cl2发生氧化还原反应生成三价铁离子,加入KSCN溶液,溶液变红色。③由题意得:Cl2+2H2O+Na2CO3=" NaCl+" NaCl+2NaHCO3。
(2)漂白粉主要成分CaCl2、Ca(ClO)2,Ca(ClO)2变质会生成CaCO3。提出假设二:该漂白粉全部变质,含CaCO3、CaCl2。根据假设可知检测CaCO3的实验方案。
