问题
问答题
如下图所示,X为氧化亚铁与氧化铜的混合物,取两份等质量的X样品进行下列实验:
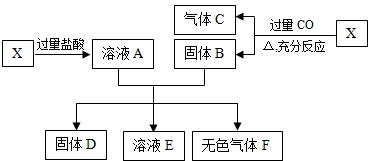
已知所得固体D的质量为16g,溶液E中含有盐酸和一种盐,气体F在标准状况下的体积为0.5g.试计算:
(1)取用的每份X中氧化亚铁与氧化铜的质量比;
(2)取用的每份X中铁与氧的原子个数比.
答案
(1)固体D的质量是Fe和CuCl2溶液反应生成的Cu和CO还原氧化铜生成的Cu的总质量,即两份X样品中铜元素的总质量,所以,每份样品中铜元素的质量为8g.每份样品中氧化铜的质量为:8g÷64×80=10g,设与盐酸反应的铁的质量为x
Fe+2HCl═FeCl2+H2↑
56 2
x 0.5g
=56 x 2 0.5g
x=14g
设与CuCl2反应的铁的质量为y
Fe+CuCl2=FeCl2+Cu
56 64
y 8g
=56 y 64 8g
y=7g
每份X样品中铁元素的质量为:14g+7g=21g
每份X样品中氧化亚铁的质量为:
21g÷
=27g56 72
因此,每份X样品中氧化亚铁和氧化铜的质量比为:27g:10g=27:10
(2)氧化亚铁和氧化铜的“分子”个数比为:
:27g 72
=3:1,每份X中铁原子和氧原子的个数比为:3:(3+1)=3:410g 80
答:每份X中氧化亚铁与氧化铜的质量比为27:10,每份X中铁与氧的原子个数比为3:4.